疾病建模和靶点发现是药物发现过程中关键的初始步骤,对药物开发的成功具有重大影响。
2023年7月19日,英矽智能的Alex Zhavoronkov等人在Trends Pharmacol Sci发表文章AI-powered therapeutic target discovery,文章回顾了靶点发现的最新进展,重点讨论了人工智能驱动的治疗靶点探索的突破。
 基于分析大型数据集和复杂生物网络的优势,人工智能在现代药物靶点识别中发挥着越来越大的作用。此前的一些AI赋能靶点发现文章参见
基于分析大型数据集和复杂生物网络的优势,人工智能在现代药物靶点识别中发挥着越来越大的作用。此前的一些AI赋能靶点发现文章参见
Drug Discov Today|药物靶点发现的组学技术比较:从蛋白质组学到配体组学
J Cheminform|基于化学结构和蛋白质序列多尺度信息的靶点预测
Open Targets|如何利用人工智能来识别药物靶点并进行优先排序
Nat Biotechnol|机器学习驱动“无假设”药物靶点发现
靶点识别概述
药物发现被广泛认为是一个耗时、昂贵且充满风险的过程,通常需要大约10年和20亿美元才能将新药推向市场。到2022年,已经确定了不到500个成功的药物靶点,只占人类估计的药物靶点的一小部分。尽管许多候选药物在临床前阶段进行了广泛的优化,但2009年至2018年临床试验的平均失败率达到了84.6%。
确定正确的药物靶点对于增加开发临床有效疗法的可能性至关重要。
尽管实验和组学技术的创新在过去几十年中一直在增长(图1),但确定可操作的治疗靶点仍然具有挑战性。本文讨论了传统的靶点识别方法,以及人工智能算法在靶点识别中的应用。
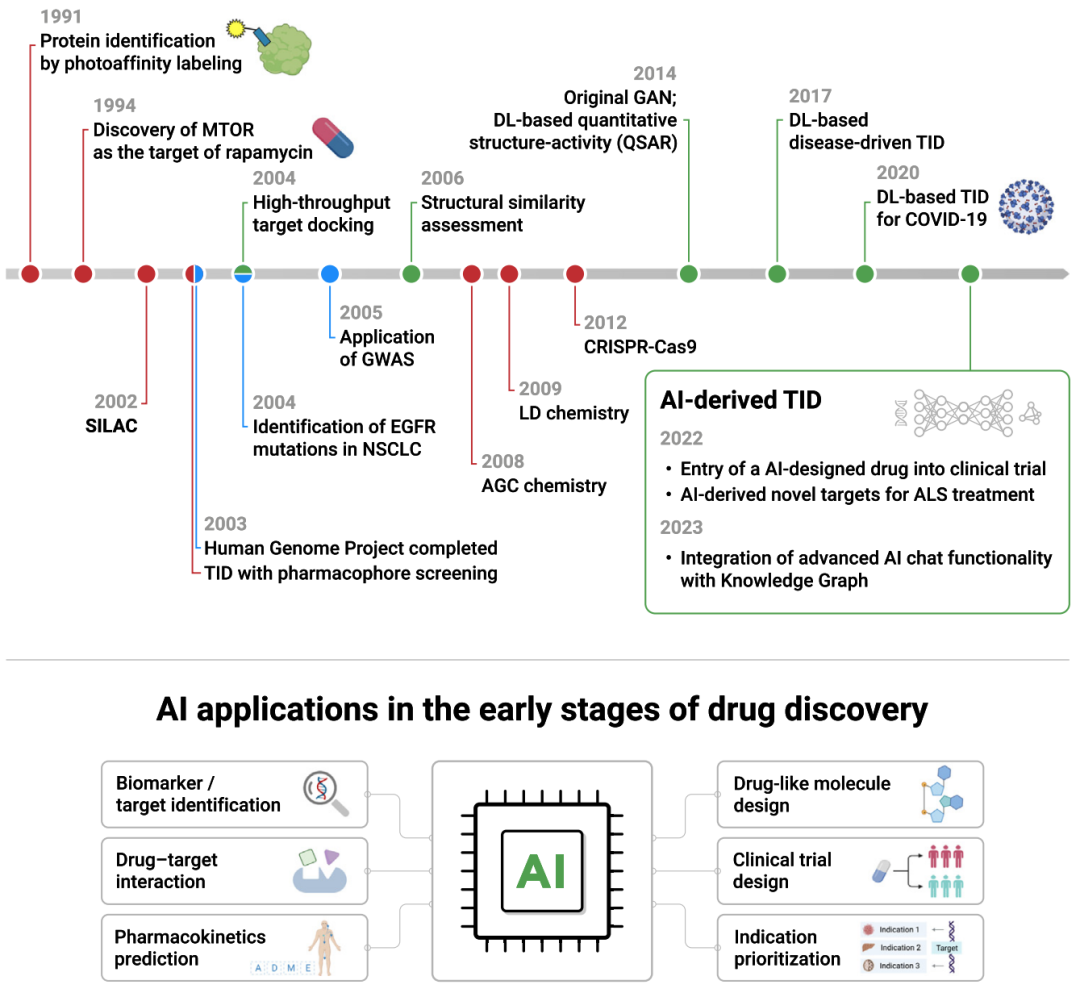
图1 人工智能在早期药物开发中的应用
靶点识别策略:从实验到机器学习
靶点识别可分为三种不同的策略:实验、多组学和计算方法(图 2)。协同使用这些方法可以在探索性靶点识别中产生新的治疗假设,从而显著增强我们对复杂疾病的理解。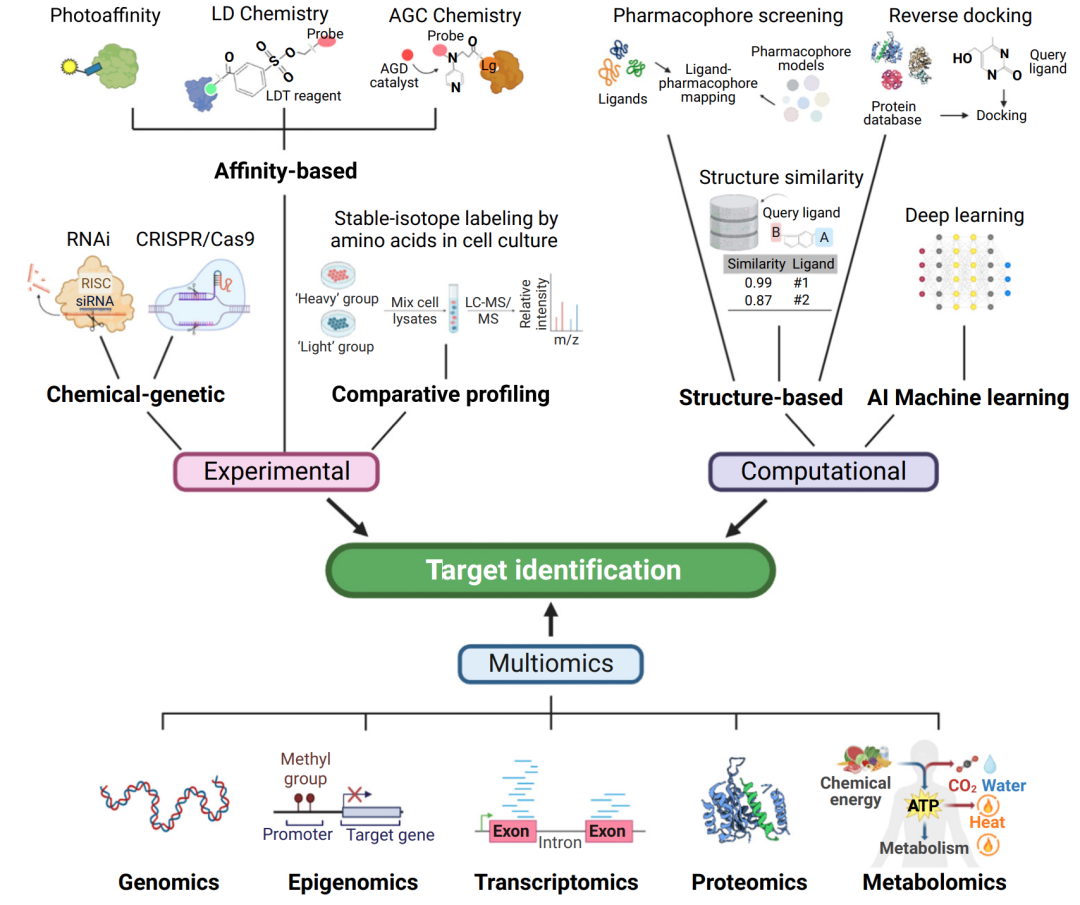
图2 靶点识别的三种探索性策略
实验方法
自1960年代以来,实验方法,包括基于亲和力的生化、比较分析和化学/遗传筛选,已经证明了它们对靶点识别的贡献。
使用小分子亲和探针可在配体与蛋白质相互作用时对蛋白质进行无痕标记,是三种实验方法中最直接的方法。细胞培养中氨基酸的稳定同位素标记(SILAC)能够有效确定疾病发病机制中关键角色。另外,通过RNA干扰(RNAi)或CRISPR-Cas9基因编辑实现的化学/遗传筛选一直备受生物学家的关注。由于其高度特异性和高效性,CRISPR极大地扩展了我们对人类疾病机理和药理学方面的认识。
多组学方法
多组学数据从不同角度为研究人员提供了相互关联的分子信息,包括静态基因组数据和时空动态表达和代谢谱。
基因组学侧重于DNA序列中的遗传变异。尽管基因组证据一直是靶点鉴定中不可或缺的内容之一,但区分导致特定疾病的致病遗传变异仍然具有挑战性(整合多个组学证据线可能是有用的)。
转录组学和蛋白质组学数据可用于鉴定调节基因和蛋白质水平的因果遗传位点,并促进发现疾病发病机制背后的基因和途径。同样,表观基因组学和代谢组学数据也可以作为GWAS鉴定变异的功能证据,以支持其疾病关联和临床应用。
与单一组学方法相比,综合多组学分析可以提供更全面的疾病机制视图,因此越来越多地用于促进生物标志物和治疗靶点的发现、治疗反应和患者预后预测。
计算方法
由于典型的基于实验的靶点识别方法费力且资源密集,因此计算方法已成为实现高效靶点筛选的有前途的替代方案。
根据蛋白质结构的可用性和靶点化合物的化学结构,药效团筛选、反向对接和结构相似性评估已被用于预测小分子的新靶点。机器学习的应用不仅限于预测现有药物或化合物的生物靶点,还可以识别任何感兴趣的疾病的新治疗靶点。
人工智能驱动的靶点识别
鉴于人工智能在处理复杂的生物医学数据网络方面的优势,使用人工智能算法可以揭示数据中可能不明显的模式和关系,更好地理解和治疗疾病。
表1 临床试验中的AI驱动的药物发现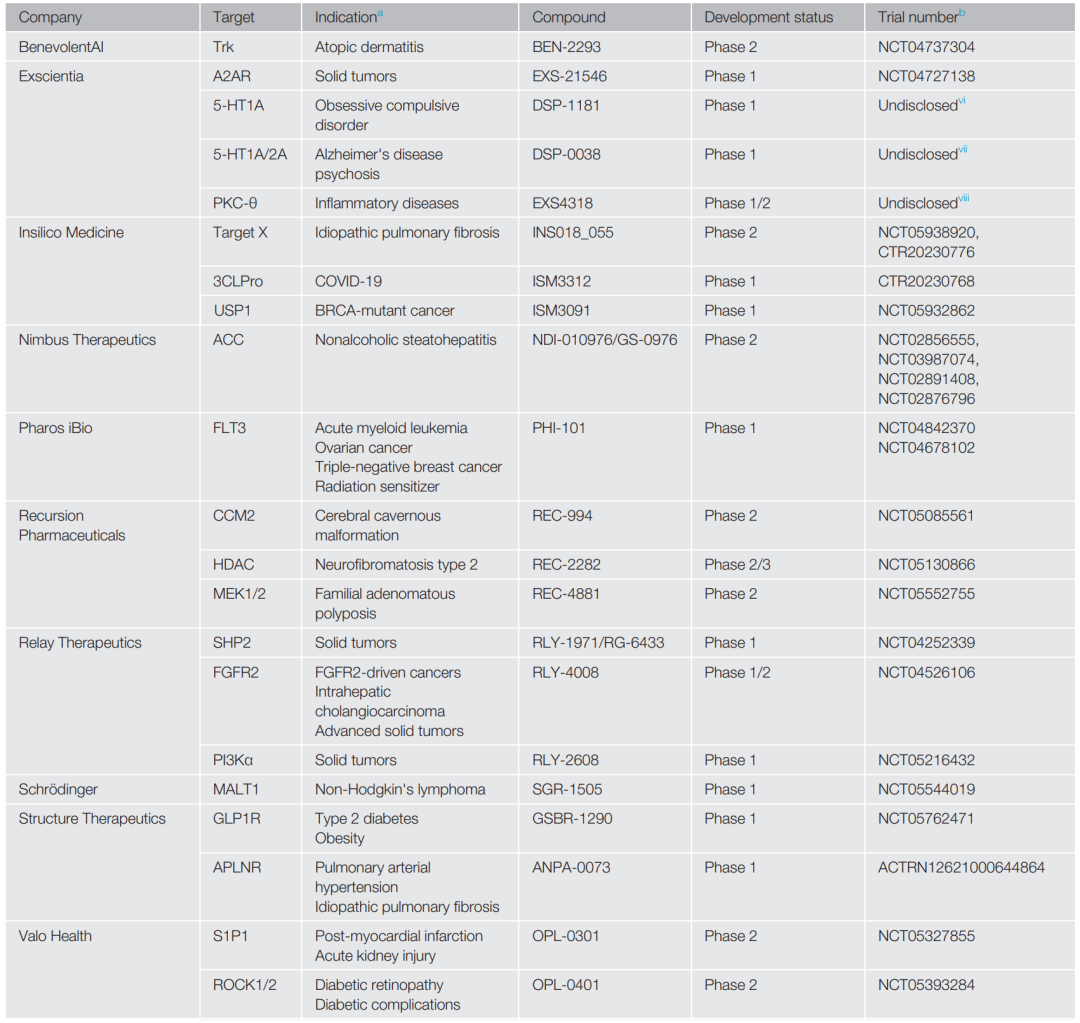
深度学习模型在靶点发现中的应用
为了确定肌萎缩侧索硬化症(ALS)的可操作治疗靶点,Pun等人结合了各种基于生物信息学和深度学习的模型,这些模型使用疾病特异性多组学和基于文本的数据进行训练,以优先考虑可药物基因,揭示了ALS治疗的18个潜在靶点。
此外,Fabris等人建立了一种基于深度学习的方法,具有新颖的模块化架构,通过学习从基因或蛋白质特征(如基因本体术语,蛋白质-蛋白质相互作用和生物途径)中检索的模式来识别与多种年龄相关疾病相关的人类基因。
West等人开发了一种深度学习集成,使用>12,000个胚胎和成体细胞的转录组谱进行训练,揭示了控制胚胎-胎儿过渡的新靶点(COX7A1),这可能有助于我们了解正常发育、表态组织再生和癌症。
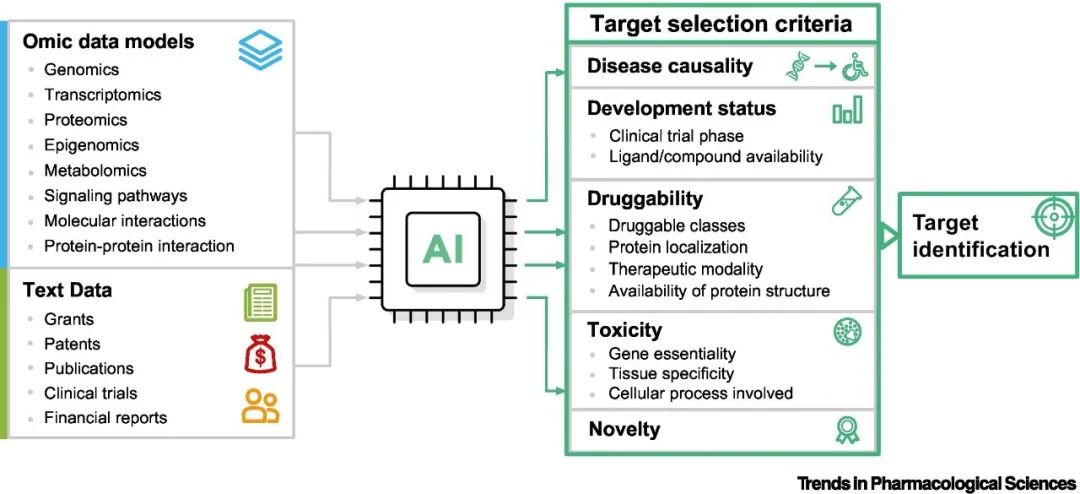
图3 人工智能驱动的靶点发现的工作流
此外,大型语言模型还有助于通过快速生物医学文本挖掘发现治疗靶点。基于大型语言模型的聊天功能,如微软的 BioGPT和 Insilico Medicine的ChatPandaGPT,可以将疾病、基因和生物过程联系起来,从而快速识别疾病发生和发展的生物机制,并确定潜在的药物靶点和生物标志物。
使用人工智能生成的合成数据进行靶点识别
“合成数据”是指模仿真实世界模式和特征的人工生成的数据。通过利用人工智能算法,可以创建合成数据来模拟各种生物场景,从而使研究人员能够探索和分析更广泛的可能性。这种方法在实验数据稀缺或难以获得的治疗领域特别有价值。例如,在罕见疾病或患者数据有限的条件下,人工智能可以根据现有的知识和模式生成合成数据。然后,这些合成数据可用于训练AI模型并确定可能被忽视的潜在治疗靶点。
此外,人工智能生成的合成数据可以帮助解决数据不平衡或偏差问题。
然而必须认识到其局限性。模拟代表性不足的人群可能会引起伦理问题,而且,确保合成数据准确捕捉现实世界生物系统的复杂性和细微差别是一项重大挑战。
为了负责任地验证和控制合成组学数据的质量,可以考虑几种选择。首先,可以进行比较分析以评估合成数据与真实世界数据之间的相似性。此外,进行基准测试有助于评估合成数据的准确性和性能。最后,让领域专家参与并进行严格的同行评审可以提供有价值的见解,并确保合成数据对靶点识别的适当性和相关性。
靶点选择标准
用于选择药物靶点的标准可以极大地影响药物开发的成功。靶点选择标准主要包括因果关系、成药性、毒性、新颖性等。
因果关系是选择药物靶点的关键标准。除了实验方法外,推断靶点与疾病之间因果关系的常见计算方法是基于网络的分析,它涉及构建生物网络,以捕获不同基因,蛋白质,药物和其他分子实体之间的关系。这些网络可用于根据其在网络中的中心性和连通性来确定可能与疾病有因果关系的潜在靶点。
另一个重要的考虑因素是靶点的成药性,即靶点被药物分子调节的能力。影响成药性的因素包括治疗方式、蛋白质定位、分类和结构可用性。例如,小分子药物通常用于具有明确结合口袋(例如激酶)的靶点,而基于蛋白质的疗法更适合于难以用小分子处理的靶点。药物靶点的结构信息有助于通过基于AI的预测进行药物设计和优化,例如AlphaFold,从而扩大了蛋白质结构的覆盖范围。
此外还必须通过评估所涉及的细胞过程、基因必要性和组织特异性来考虑靶点毒性。
新颖性是靶点选择中的另一个关键标准。基于文本的证据可用于评估给定靶点的新颖性和可信度。通过仔细研究已批准的药物、分子靶点和治疗适应症之间的关系,Santos等人发现,高置信度靶点(或“特权”靶点家族)占已批准药物的大多数。在新颖性和信心之间取得平衡对于靶点选择至关重要。
人工智能驱动的自然语言处理方法可以通过提取支持证据来帮助这一靶点选择过程。此外,人们已经开发了量化靶点新颖性和置信度的工具(如TIN-X)。人工智能可以通过将具有已知药物的高置信度靶点与尚未研究药物的新疾病联系起来来促进药物再利用,从而为常见和罕见疾病提供具有成本效益和节省时间的药物发现。
在实验中验证的AI识别靶点
使用细胞和动物模型进行靶点验证是靶点发现的关键步骤,可降低制药行业的项目损耗率和药物开发成本。越来越多的人工智能识别靶点正在成功验证。
例如,在模拟ALS的果蝇模型中验证了28个AI提出的用于ALS治疗的靶点,揭示了8个未报告的靶点。此外, Zhang等人开发了一种基于机器学习的方法,将KANK1鉴定为与ALS相关的新基因,并验证了CRISPR-Cas1在人类神经元中复制的KANK9突变的神经毒性作用。CDK20被确定为使用基于深度学习的方法治疗HCC的靶点,并且由生成AI设计的高效小分子抑制剂在HCC细胞系中显示出选择性抗增殖活性。
靶点验证方面的进展
使用细胞和动物模型进行靶点验证对于确认所提出的靶点对疾病发展的调节作用至关重要。尽管2D细胞培养和啮齿动物模型是靶点验证的主流工具,但系统建立的困难以及人体发展的复杂性或概括性不足限制了它们作为具有高度代表性的模型的能力。
类器官通过允许在体外捕获组织结构和细胞微环境,已成为疾病研究和药物测试的一种有前途的技术。利用类器官的自组织能力,能够模拟实际器官发育,并已成功建立用于多种人体器官(如肠、胃、肺、肝、肾、脑)的致病机制,探索各种疾病的致病机制。
实验室自动化可以通过提高数据生成率、减少人为技术差异和避免污染物暴露来大大提高工作效率和可重复性。例如,Insilico Medicine推出了一个人工智能驱动的机器人实验室,这是其端到端人工智能药物发现平台的互联扩展。自动化的逐步集成将彻底改变实验室环境,以最大限度地提高研究成功率。
结束语和未来展望
鉴于人体中只有一小部分潜在的成药靶点被鉴定出来,因此迫切需要有效的靶点发现方法。越来越多的人工智能识别靶点在实验中得到验证,这凸显了将人工智能算法纳入靶点识别的好处,以提高新靶点发现和新疗法开发的效率。
尽管在人工智能驱动的靶点发现方面取得了巨大进展,但仍存在一些悬而未决的问题和挑战。伦理考虑、数据隐私和监管框架是必须解决的关键方面,以确保在药物开发中负责任和合乎道德地部署人工智能。此外,人工智能算法的可解释性对于获得科学和医学界的信任和接受至关重要。值得注意的是,尽管人工智能在加快药物发现的早期阶段(如靶点识别和先导物优化)方面显示出潜力,但它无法显著缩短药物开发过程中临床试验所需的时间。这是因为无论药物是否由人工智能开发,都需要花费很长时间进行道德和监管审批、患者招募、治疗持续时间和数据分析。
总之,人工智能已成为靶点发现和药物开发的有力工具,并且正在彻底改变我们识别新药靶点和重新利用现有药物的方式。我们可以期待人工智能在加速开发针对各种疾病的安全有效疗法方面发挥不可或缺的作用,最终改善人类健康和福祉。
参考资料
Pun FW, Ozerov IV, Zhavoronkov A. AI-powered therapeutic target discovery. Trends Pharmacol Sci. 2023 Sep;44(9):561-572. doi: 10.1016/j.tips.2023.06.010.
——— End ———



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


