
导语
北京师范大学系统科学学院/非平衡系统研究所李辉教授研究组长期开展生物复杂系统的动力学研究,探究细胞内的输运动力学以及细胞迁移的相关生物物理问题。近日该课题组在 Nature Communications 发表最新成果,发现细胞能够在快慢两种迁移模式之间动态可逆的转换,调节细胞的速度和方向,对外部环境的各种变化做出反应。
该工作从研究细胞内扩散动力学的物理新视角出发,揭示了细胞迁移行为从生物大分子和亚细胞结构的复杂系统涌现,为调控人体细胞迁移以及相关疾病诊断策略提供了新思路,也有助于探索发展生命体系的非平衡物理,启发设计具有丰富功能的人造活性物质体系。
研究领域:生命复杂系统,生物物理,细胞迁移,扩散动力学,涌现

系统科学 | 来源
兰松 | 供稿
王大辉 | 审校
细胞作为由大量生物分子构成的复杂系统,细胞迁移(运动)涵盖了重要的多时空尺度复杂科学问题,即如何由个体层面的纳米、毫秒尺度的分子运动,涌现出系统层面的微米、秒尺度的细胞运动。细胞迁移在形态发生、伤口愈合和肿瘤转移等生命过程中发挥了关键作用,因而也是物理、生物、化学、工程等跨学科交叉研究的前沿领域之一。自从发现细胞的趋向性以来,细胞迁移的研究历史已超过一个世纪,基本确立了细胞迁移的稳态运行机制。然而,迁移细胞的速度和方向在迁移过程中不断动态变化,但其调控机制并不清楚。
过去的研究已经涉及了细胞迁移的很多方面,如信号通路、骨架结构、细胞形态、细胞力学、细胞外基质及胞外环境拓扑结构等,但是仍缺乏对细胞迁移过程中胞内扩散动力学的理解。扩散是细胞内生物分子输运的物理基础,介导了许多重要的生物功能,在细胞迁移过程中尤为重要:细胞迁移基于细胞伪足前端的微丝快速聚合来推动细胞膜向前伸展,同时细胞后部的微丝解聚。该过程中,细胞后部微丝解聚而成的亚基及其他相关的大分子蛋白借助扩散的方式被运输到前端并循环使用。同时,细胞内分子扩散也受到多种亚细胞结构和微环境的密切影响,而后者随细胞迁移过程中形态和结构的变化而发生动态调整。因此,扩散关联到从分子、亚细胞到细胞的不同尺度,是研究细胞迁移复杂调控机制的关键切入点。
北京师范大学系统科学学院/非平衡系统研究所李辉教授研究组长期开展生物复杂系统的动力学研究,发展了活细胞三维单分子动态成像技术和定量分析方法 [STAR Protocols 3, 101790 (2022)],探究了细胞内的输运动力学以及细胞迁移的相关生物物理问题 [JACS 137, 436 (2015);PNAS 115, 12118 (2018);CPL(Express Letters) 37, 078701(2020); PNAS 118, e2022422118 (2021); iScience 25, 104210 (2022); Small 18, 2106498 (2022)]。

近期,李辉教授与中国科学院物理研究所王鹏业研究员团队合作,从测量细胞内扩散动力学出发,发现了细胞调控速度和方向的迁移模式切换机制。利用活细胞三维单分子跟踪技术,实时同步观测了角质细胞的迁移行为以及细胞内量子点的扩散动力学,并结合了超分辨荧光显微成像STED、原子力显微镜AFM、显微操纵等多种实验技术,系统研究了分子层级的胞内扩散动力学、亚细胞层级的伪足三维结构、以及细胞层级的迁移行为三者之间的复杂关系,发现了新的细胞迁移模式,揭示了细胞速度和方向的多尺度协同调控机制。
该研究发现:(1)细胞内的扩散速率与细胞的迁移速度呈正相关(图1);(2)存在一种新的细胞慢速迁移模式,细胞在快速和慢速两种模式间可逆转换,以调控细胞的迁移速度。与传统的细胞快速迁移不同,慢速迁移细胞具有前高后低的板状伪足、胞内扩散速度降低、生物大分子局限于伪足前端的特征(图2);(3)在细胞的转向运动过程中,细胞内部扩散动力学和板状伪足三维结构出现了左右的对称性破缺,表现为处于转向外侧的伪足变厚且内部扩散速度下降(图3)。基于上述研究,我们提出了一种细胞调控胞内局部微丝聚合以及分子拥挤程度的生物物理机制对细胞迁移模式的可逆转换进行了解释(图4)。
细胞能够在快慢两种迁移模式之间动态可逆的转换,就像车辆行驶中的“挡位切换”,调节了细胞的速度和方向,以对外部环境的各种变化做出反应。这种细胞层级的迁移模式切换,与胞内分子层级的扩散速度调节、以及亚细胞层级的结构调整,紧密耦合在一起。该研究深化了从生物结构、动力学、到功能的联系,更加系统性的理解细胞迁移的调控过程:在细胞将要快速迁移时,其板状伪足开始变得非常扁平,扩散主要局限于准二维平面,有效提高了微丝亚基和其他相关蛋白质的输运效率,从而有效促进并维持细胞的快速迁移;而在细胞将要慢速迁移时,板状伪足前端开始膨胀、后端压缩,将生物大分子聚集在伪足前端,并由于分子局部拥挤程度的增加而显著降低了分子扩散,进而导致细胞迁移减慢。
该工作从研究细胞内扩散动力学的物理新视角出发,揭示了细胞迁移行为从生物大分子和亚细胞结构的复杂系统涌现及其调控规律,为调控人体细胞迁移以及相关疾病诊断策略提供了新的思路,也有助于探索发展生命体系的非平衡物理,启发设计具有丰富功能的人造活性物质体系。
相关成果以“Switch of cell migration modes orchestrated by changes of three-dimensional lamellipodium structure and intracellular diffusion”为题发表在 Nature Communications 14, 5166, (2023)。该文章被编辑推荐并收录于多尺度生物复杂系统研究专题“From molecules and cells to organisms” (详见https://www.nature.com/collections/bbcaeejggj)。该工作获得了国家自然科学基金和中国科学院的支持。
文章信息:Chao Jiang, Hong-Yu Luo, Xinpeng Xu, Shuo-Xing Dou, Wei Li, Dongshi Guan, Fangfu Ye, Xiaosong Chen, Ming Guo, Peng-Ye Wang & Hui Li. Switch of cell migration modes orchestrated by changes of three-dimensional lamellipodium structure and intracellular diffusion. Nature Commun. 14, 5166 (2023).
文章链接:https://www.nature.com/articles/s41467-023-40858-x
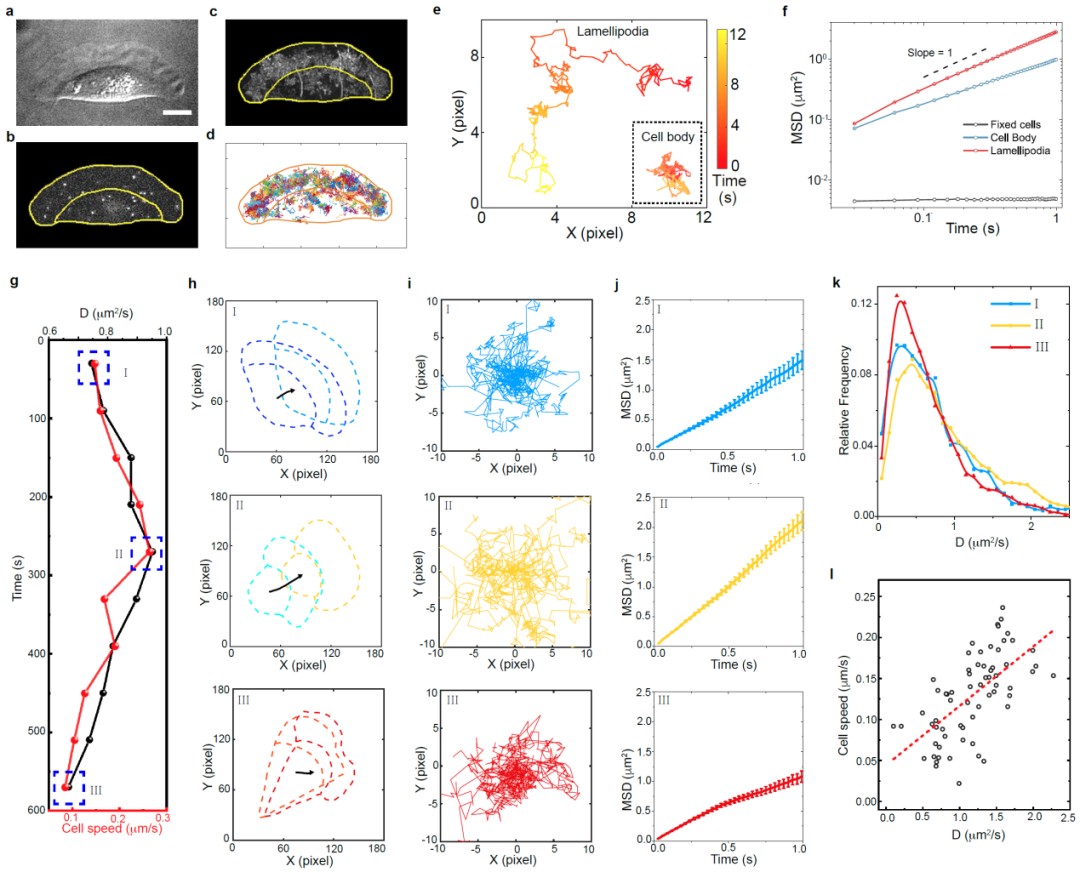
图1. 角质细胞的迁移速度与内部量子点的扩散速度正相关。
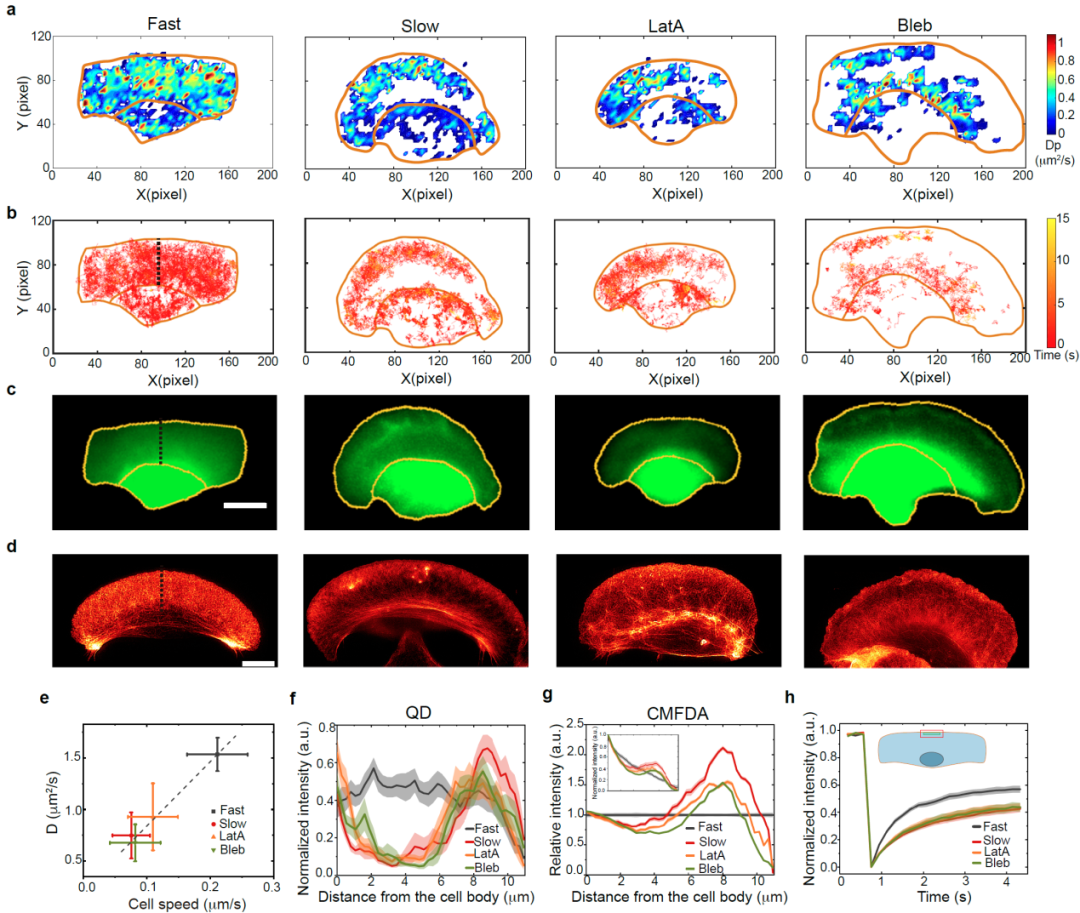 图2. 发现新的细胞慢速迁移模式。与传统的细胞快速迁移模式不同,在慢速迁移细胞中。其板状伪足前高后低、胞内扩散速度降低,生物大分子局限于伪足前端。
图2. 发现新的细胞慢速迁移模式。与传统的细胞快速迁移模式不同,在慢速迁移细胞中。其板状伪足前高后低、胞内扩散速度降低,生物大分子局限于伪足前端。
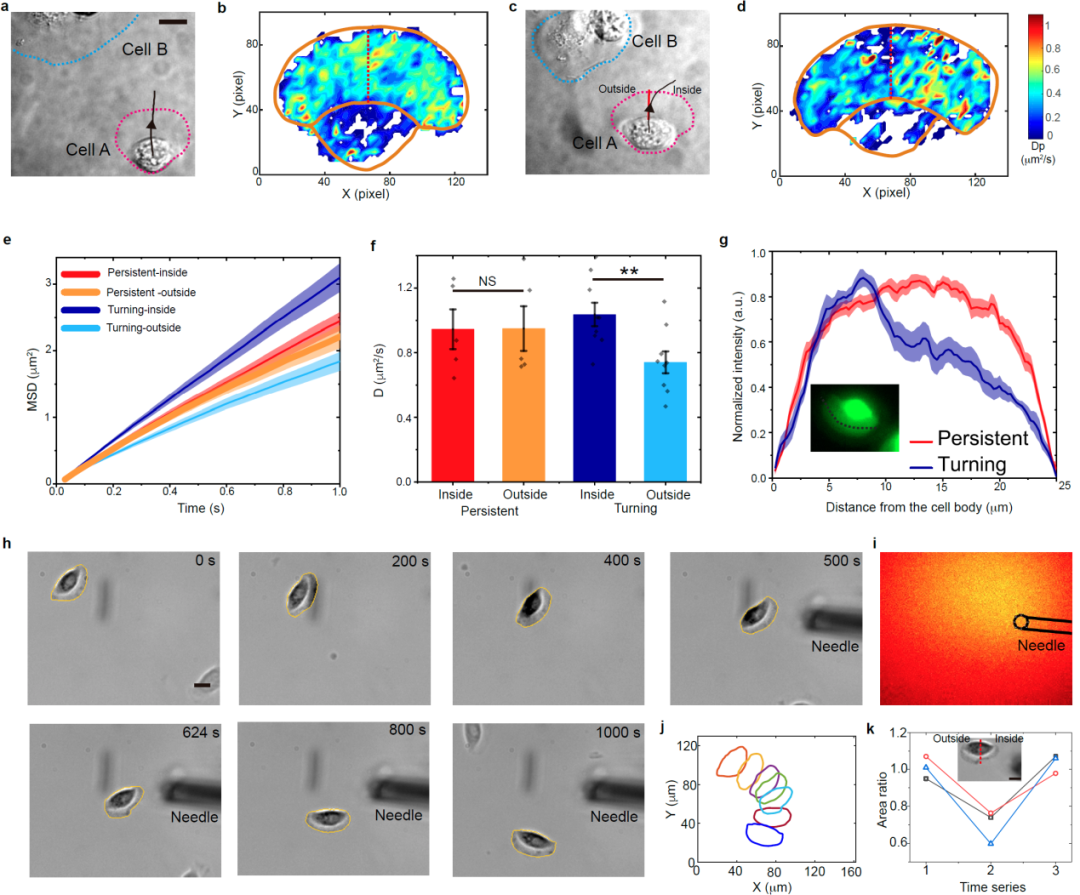 图3. 细胞转向过程中的胞内扩散和伪足三维结构出现左右对称性破缺:处于转向外侧的伪足变厚且内部扩散速度下降。
图3. 细胞转向过程中的胞内扩散和伪足三维结构出现左右对称性破缺:处于转向外侧的伪足变厚且内部扩散速度下降。
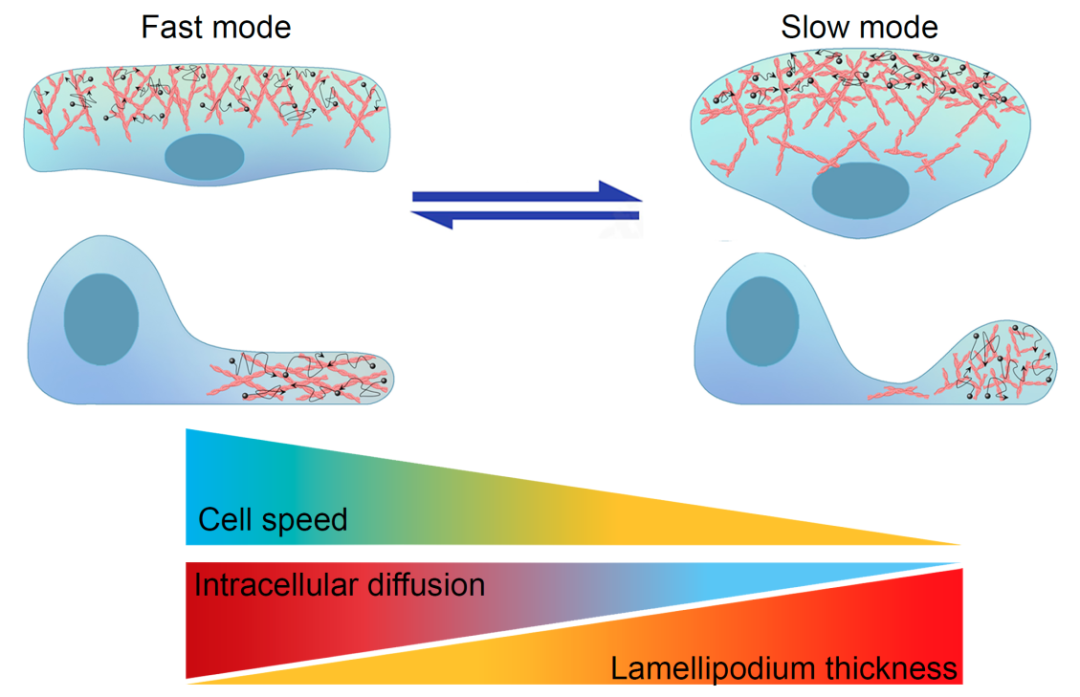
图4. 细胞迁移模式转换的生物物理机制。
已有研究表明,当微丝的末端与伪足前端细胞膜接触时才能持续延长,因此,当细胞处于正常的快速迁移模式时,只有近似垂直于膜的微丝才能快速聚合,以保持与前端细胞膜的持续触。当细胞速度开始要减慢,更多朝向的微丝在细胞前端形成,导致板状伪足前端膨胀而后端压缩(细胞总体积保持不变),让伪足内的生物大分子被挤到前端,造成伪足前端分子拥挤程度增加以及内部扩散速度相应地下降,从而细胞转为慢速迁移模式。而当细胞膜前进速度开始要增加时,微丝的密度逐步降低,板状伪足恢复至扁平形态,胞内扩散变得均匀,细胞从而由慢速迁移模式转换回快速模式。在转向的细胞中,细胞两侧伪足的速度不平衡,外侧收缩而内侧扩张。由于外侧伪足的细胞膜前进速度降低,导致该侧的微丝网络变得密集,局部分子拥挤变强,导致外侧伪足厚度增加以及内部扩散速率下降。
生命复杂性系列读书会
生命是什么?生命怎样起源?生命怎样演化?这些是对生命现象的本质追问,除了传统的生物学研究,如今有大量来自信息、物理、计算机领域的工具方法,正在揭开生命复杂性谜题。基于此,集智俱乐部策划“生命复杂性”系列读书会,自2020年11月5日至今,近百名在从事相关问题研究的老师同学或感兴趣的朋友参与。
了解读书会具体规则、报名读书会请点击下方文章:
推荐阅读
1. Nat.Commun.速递:离体神经细胞网络“打乒乓球”时的临界动力学2. 从细胞到解剖稳态的扩展:从个体发育到集体智能3. 细菌如何决定何时分裂?随机过程视角下的细菌细胞分裂调控4. 张江:第三代人工智能技术基础——从可微分编程到因果推理 | 集智学园全新课程5. 成为集智VIP,解锁全站课程/读书会6. 加入集智,一起复杂!
点击“阅读原文”,报名读书会



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


