 目前,药物研究领域面临着如何快速搜索到具有活性的先导化合物的重要挑战。通过高通量筛选发现新骨架化合物是一个繁琐且耗费资源的过程,并且商业上可供使用的小分子库中有数百万个化合物,使得全面进行体外实验变得困难且限制了在大型数据库中广泛应用的可能性。而传统(Computer-Aided Drug Design,CADD)方法如虚拟筛选在大型分子数据库上进行搜索效率较低,随着人工智能(Artificial Intelligence,AI)在药物研究领域的应用,新的可能性正在出现。利用AI算法将大规模分子库缩减为针对特定目标的少数几百个小分子集合中识别活性小分子,从而实现更快速和更具成本效益的药物发现过程。
基辅国立大学Yurii S. Moroz小组通过利用AI算法将大型筛选化合物库集合减少到仅针对数百个小分子的特定集合,应用这种新型虚拟筛选策略从260万个化合物中挑选出434个潜在靶向抑制sirtun -1蛋白的小分子,仅为原始库的0.02%。经过多阶段体外验证最终确认了7种新型抑制剂。与针对Sirtuin-1的竞争性基准研究相比,该方法提高12倍的命中率。这些结果表明,利用人工智能从大型筛选库中进行预筛选的方法能够显著减少体外测试的小分子数量,同时仍然保持较高的活性分子命中率。该项研究工作发表在美国化学会出版的药物化学核心期刊Journal of Medicinal
目前,药物研究领域面临着如何快速搜索到具有活性的先导化合物的重要挑战。通过高通量筛选发现新骨架化合物是一个繁琐且耗费资源的过程,并且商业上可供使用的小分子库中有数百万个化合物,使得全面进行体外实验变得困难且限制了在大型数据库中广泛应用的可能性。而传统(Computer-Aided Drug Design,CADD)方法如虚拟筛选在大型分子数据库上进行搜索效率较低,随着人工智能(Artificial Intelligence,AI)在药物研究领域的应用,新的可能性正在出现。利用AI算法将大规模分子库缩减为针对特定目标的少数几百个小分子集合中识别活性小分子,从而实现更快速和更具成本效益的药物发现过程。
基辅国立大学Yurii S. Moroz小组通过利用AI算法将大型筛选化合物库集合减少到仅针对数百个小分子的特定集合,应用这种新型虚拟筛选策略从260万个化合物中挑选出434个潜在靶向抑制sirtun -1蛋白的小分子,仅为原始库的0.02%。经过多阶段体外验证最终确认了7种新型抑制剂。与针对Sirtuin-1的竞争性基准研究相比,该方法提高12倍的命中率。这些结果表明,利用人工智能从大型筛选库中进行预筛选的方法能够显著减少体外测试的小分子数量,同时仍然保持较高的活性分子命中率。该项研究工作发表在美国化学会出版的药物化学核心期刊Journal of MedicinalChemistry上(DOI:10.1021/acs.jmedchem.3c00128)【1】。 Sirtuin-1蛋白是一种在细胞调控中扮演重要角色的酶。通过去除蛋白质上的乙酰基修饰,Sirtuin-1可以影响染色质结构调整、基因表达、细胞凋亡等,开发Sirtuin-1抑制剂有望为治疗肥胖引起的糖尿病、与衰老相关的疾病提供新的可能性。该项研究工作目的是从Enamine数据库(~260万分子)中寻找Sirtuin-1新型小分子抑制剂。为此,研究开发了一种包括基于AI的虚拟筛选、多阶段体外验证和分子动力学模拟的策略。 PharmAI DiscoveryEngin以基于知识的方式运行,从蛋白质数据库(PDB)中挖掘所有适合的结合位点,并将它们转换成独特的指纹,描述结合位点的几何、物理化学和非共价相互作用特性。在此抽象表示的基础上,以Sirtuin1已知晶体结构为参照,通过计算参照结合位点与所有已知结合位点之间的相似性,进而生成小分子的初级骨架,最后将其外推到所需的筛选库中。利用这些信息,作者从Enamine筛选库的260万个分子中筛选到434个具有显著结合可能性的Sirtuin-1的化合物骨架和类似物。高通量热稳定性试验(TSA)测试结果显示,14个化合物的融解温度发生明显变化,表明它们与Sirtuin具有显著结合能力。 通过蛋白质碳酸酐酶的结合实验,去除5个非选择性化合物,对剩下的9种化合物进行浓度相关的热稳定迁移实验,说明这些化合物与蛋白结合具有浓度依赖性。随后测试这九个化合物对酶活性的抑制作用,使用发光Promega SIRT-Glo检测系统进行功能分析。实验结果显示,这九个化合物在Sirtuin-1蛋白上表现出特异性的浓度依赖性效果,在低μM范围内,有7个化合物表现出显著的抑制作用。其中,化合物#8表现出最高的抑制效果,其IC50值为1.2 μM(图2)。最后用LC/MS无标记法评估化合物的抑制作用,测试结果显示,化合物#1和化合物#5对Sirtuin-1酶活性的抑制效率分别为28.4±6.8%和41.7±9.9%,表现出明显的活性(图1)。
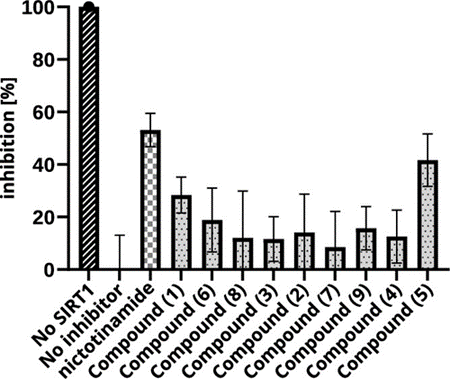
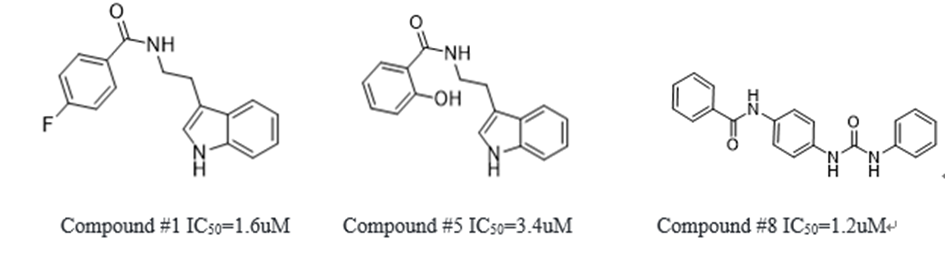 图1:若干筛选得到的Sirtuin-1的抑制剂的化学结构及抑制活性
作者采用分子动力学模拟研究化合物#1与受体蛋白的作用模式。结果表明,特定的疏水作用和高度保守的氢键相互作用是主要的驱动因素(图2):化合物(1)的氟原子与Ser265和Ile270的侧链原子Cβ和Cγ2形成了两个极化的C-H键。苯酰胺氧与Arg274的Nη1和Nη2以及Val412的主链氧与4-氟基之间形成了两个稳定的蛋白–配体氢键, Phe273和Phe297的芳香侧链与预测配体的氟苯基部分和吲哚环形成疏水相互作用。吲哚进一步被His363的咪唑侧链配位,导致配体在His363和Phe297之间堆叠。基于上述研究,最终确定两类骨架化合物:(1) 吲哚类化合物(化合物#1-5和化合物#9);(2) 尿素类化合物(化合物#6和化合物#8)作为后续优化的起点。
图1:若干筛选得到的Sirtuin-1的抑制剂的化学结构及抑制活性
作者采用分子动力学模拟研究化合物#1与受体蛋白的作用模式。结果表明,特定的疏水作用和高度保守的氢键相互作用是主要的驱动因素(图2):化合物(1)的氟原子与Ser265和Ile270的侧链原子Cβ和Cγ2形成了两个极化的C-H键。苯酰胺氧与Arg274的Nη1和Nη2以及Val412的主链氧与4-氟基之间形成了两个稳定的蛋白–配体氢键, Phe273和Phe297的芳香侧链与预测配体的氟苯基部分和吲哚环形成疏水相互作用。吲哚进一步被His363的咪唑侧链配位,导致配体在His363和Phe297之间堆叠。基于上述研究,最终确定两类骨架化合物:(1) 吲哚类化合物(化合物#1-5和化合物#9);(2) 尿素类化合物(化合物#6和化合物#8)作为后续优化的起点。
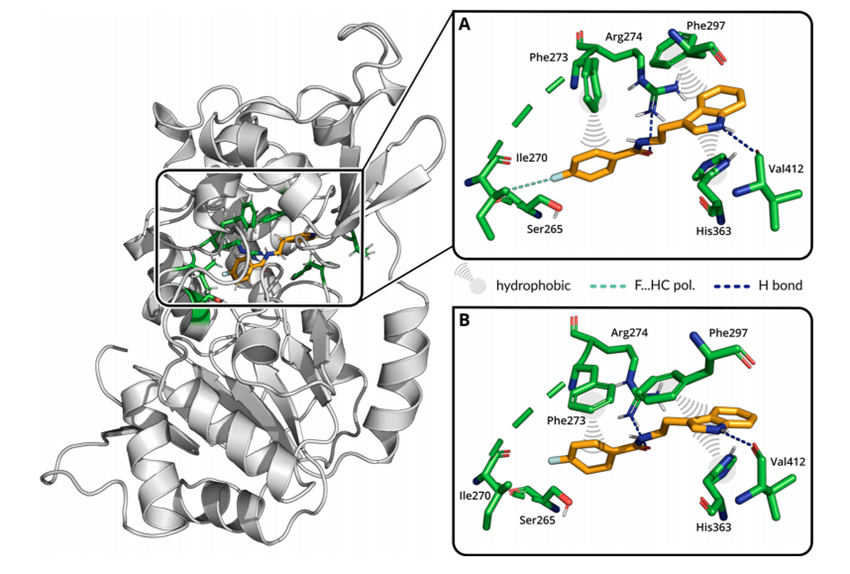 图2: 化合物(1)与Sirtuin-1 (PDB 4ZZI)聚类分析结合模式(A,B表示观察到的不同开关下疏水结合模式的状态,氨基酸Phe297和His363与配体产生疏水相互作用,Arg274和Val412与配体形成氢键相互作用)
本研究将PharmAI DiscoveryEngine的方案与其他方法进行对比。研究采用了Chiba等人描述的竞赛方案的流程,共有16个团队参与,通过不同的算法预测出新的Sirtuin-1抑制剂。共得到3129种化合物,即每组约200种化合物,进行体外测试显示七个化合物有活性,对应于所有团队的平均命中率为0.22%(7/3192),其中四个化合物(0.13%)的IC50≤ 10 μM。相比之下,本研究利用PharmAI虚拟筛选预测得到了九个命中化合物,命中率为2.1%(9/434),其中有七个化合物(1.6%)的IC50 ≤
图2: 化合物(1)与Sirtuin-1 (PDB 4ZZI)聚类分析结合模式(A,B表示观察到的不同开关下疏水结合模式的状态,氨基酸Phe297和His363与配体产生疏水相互作用,Arg274和Val412与配体形成氢键相互作用)
本研究将PharmAI DiscoveryEngine的方案与其他方法进行对比。研究采用了Chiba等人描述的竞赛方案的流程,共有16个团队参与,通过不同的算法预测出新的Sirtuin-1抑制剂。共得到3129种化合物,即每组约200种化合物,进行体外测试显示七个化合物有活性,对应于所有团队的平均命中率为0.22%(7/3192),其中四个化合物(0.13%)的IC50≤ 10 μM。相比之下,本研究利用PharmAI虚拟筛选预测得到了九个命中化合物,命中率为2.1%(9/434),其中有七个化合物(1.6%)的IC50 ≤10 μM。与IC50阈值为10 μM的其他组预测相比,这是一个显著的12倍改进。这些结果表明, PharmAI虚拟筛选可以在大大减少生物测试的化合物数量的同时提高活性化合物的命中率。 小结:在本项工作中,作者应用人工智能方法PharmAI
DiscoveryEngine对数百万级的化合物库进行虚拟筛选,将实验范围缩小至数百化合物,成功发现了若干具有Sirtuin1蛋白抑制活性的苗头化合物。这种人工智能驱动的虚拟筛选流程有望在其他靶标上也得到应用,在创新药物发现的早期阶段具有巨大潜力。 参考文献 【1】Gryniukova A, Kaiser F, Myziuk I, Alieksieieva D,
Leberecht C, Heym PP, Tarkhanova OO, Moroz YS, Borysko P, Haupt VJ. AI-Powered
Virtual Screening of Large Compound Libraries Leads to the Discovery of Novel
Inhibitors of Sirtuin-1. J Med Chem. 2023 Aug 10;66(15):10241-10251.
正文完
可以使用微信扫码关注公众号(ID:xzluomor)



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


