新智元报道
编辑:Lumina 润
【新智元导读】有着诺奖风向标之称的拉斯克奖揭晓了!因推出AlphaFold,谷歌DeepMind获得了基础医学研究奖,人工智能彻底改变了生物学的研究。
9月21日,生理学和医学领域的顶级大奖拉斯克(The Lasker Awards)奖揭晓了! 拉斯克奖设有四个不同的奖项:基础医学研究奖、临床医学研究奖、公共服务奖以及医学科学特别成就奖。今年的拉斯克奖的基础医学研究奖授予了来自Google DeepMind的Demis Hassabis和John Jumper,他们发明的AlphaFold在蛋白质三维结构预测方面做出了革命性的贡献。
拉斯克奖设有四个不同的奖项:基础医学研究奖、临床医学研究奖、公共服务奖以及医学科学特别成就奖。今年的拉斯克奖的基础医学研究奖授予了来自Google DeepMind的Demis Hassabis和John Jumper,他们发明的AlphaFold在蛋白质三维结构预测方面做出了革命性的贡献。 拉斯克奖可谓是诺贝尔奖的「风向标」,自1945年奖项成立以来,有86位拉斯克奖获得者同时也获得了诺贝尔奖。中国首位诺贝尔生理学或医学奖得主屠呦呦也曾在获诺奖的四年前获拉斯克奖。
拉斯克奖可谓是诺贝尔奖的「风向标」,自1945年奖项成立以来,有86位拉斯克奖获得者同时也获得了诺贝尔奖。中国首位诺贝尔生理学或医学奖得主屠呦呦也曾在获诺奖的四年前获拉斯克奖。
AlphaFold带来的蛋白质生物学革命
基于人工智能系统的AlphaFold解决了生理物理学(biophysics)中长达六十年的重大挑战:仅基于主要的氨基酸序列(1D)预测蛋白质结构(3D)。Jumper和Hassabis领导的AlphaFold团队融合了不同的背景和学科,2021年7月,AlphaFold向公众开放后,众多研究人员已经采用这个平台来回答各种生物学问题。从这以后,生物学研究的格局被彻底改变了。
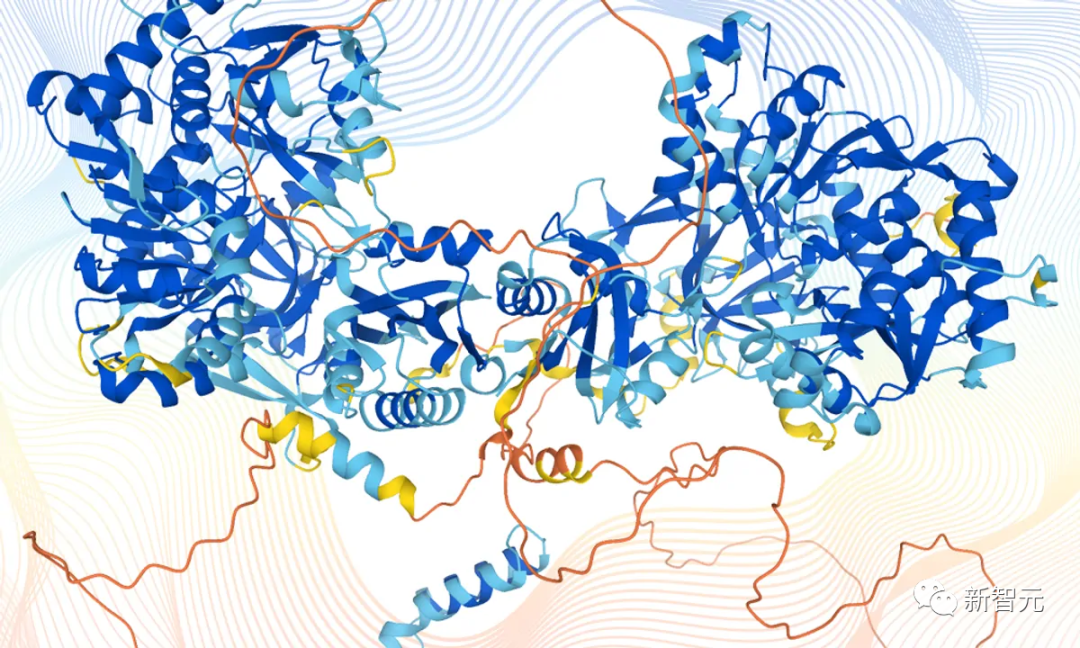
AlphaFold预测的蛋白质结构图蛋白质的重要性是不言而喻的,它是细胞中的主要功能分子,几乎涉及了每个生物学过程。但在之前,即使是测定单一的蛋白质结构也非常困难。几十年来,科学家们一直严重依赖X射线晶体学来进行蛋白质鉴定研究,但研究人员可能要花费数年时间才能将蛋白质晶体化。后来,低温电子显微镜(cryo-EM)的发明让人们对蛋白质难以捉摸的结构有了一些了解,但显微镜图像的分辨率往往很低。低温电子显微镜经过多年的缓慢发展,到2019年,科学家利用低温电子显微镜确定了蛋白质数据库(PDB)中15万个条目中近4000个蛋白质的结构。而这只是预计的数千万个蛋白质序列中的一小部分。
自动化蛋白质结构预测
面对巨大数量的蛋白质结构,单靠人力已难以为继。为了扩大预测的范围、提高效率,研究人员转向了人工智能。1994年,马里兰大学的计算生物学家John Moult和Krzysztof Fidelis创办了结构预测关键评估(CASP),这是一项两年一度的测试,旨在让参赛小组预测几种已通过实验验证但尚未公开发布的蛋白质的三维结构。最早用计算机预测蛋白质结构的方法之一是由华盛顿大学的生物化学家和计算生物学家David Baker开发的。他使用PDB中的短片段来预测蛋白质结构,Baker和他的团队利用名为Rosetta的模型进行了多次迭代,不断提高程序在2000年代初CASP竞赛中的表现。但之后,CASP的进展却停滞不前。DeepMind是Hassabis在2010年合伙创立的一家人工智能公司,它成功设计出了能在国际象棋和更具挑战性的围棋中击败人类棋手的人工智能AlphaGo。 在Hassabis观看AlphaGo的比赛时,他想起了Baker在2008年发布的在线游戏《FoldIt》,玩家可以在游戏中探索并创建精确的蛋白质结构模型。2016年,AlphaGo取得成功后不久,DeepMind便瞄准了下一个挑战:蛋白质折叠。DeepMind团队创建了一个蛋白质预测系统,将机器学习作为该系统的核心组成部分。在2018年,AlphaFold1在CASP竞赛中首次亮相,拿下了当年的冠军。AlphaFold1为43个建模领域中的24个创建了高精度结构,给人留下了深刻的印象,第二名仅创建了14个。但AlphaFold1的潜力还远没有被开发。于是不久之后,Jumper率领着一个由生物学家、化学家和生物物理学家组成的跨学科团队重新设计了AlphaFold算法。Hassabis、Jumper和AlphaFold团队集思广益,对算法进行了微调,以确保AlphaFold2能高效地学习。在2020年举行的下一届CASP竞赛中,AlphaFold2以惊人的精确度震惊了与会者:AlphaFold2在所有目标的总分中位数达到92.4 GDT。这种精确度可与实验技术相媲美,平均误差仅相当于一个原子的宽度。随后在2021年,DeepMind与欧洲分子生物学实验室的欧洲生物信息学研究所合作,公布了AlphaFold的源代码及其令人印象深刻的35万个蛋白质数据库。现在,该数据库中的蛋白质结构数量已增至2亿多个。Hassabis、Jumper和他们的团队解决了一个困扰科学家半个世纪的难题。AlphaFold这一人工智能工具,开创了研究蛋白质以了解生物功能和指导药物开发的新时代。人工智能技术的进步从根本上改变了科学家解决问题的方式。
在Hassabis观看AlphaGo的比赛时,他想起了Baker在2008年发布的在线游戏《FoldIt》,玩家可以在游戏中探索并创建精确的蛋白质结构模型。2016年,AlphaGo取得成功后不久,DeepMind便瞄准了下一个挑战:蛋白质折叠。DeepMind团队创建了一个蛋白质预测系统,将机器学习作为该系统的核心组成部分。在2018年,AlphaFold1在CASP竞赛中首次亮相,拿下了当年的冠军。AlphaFold1为43个建模领域中的24个创建了高精度结构,给人留下了深刻的印象,第二名仅创建了14个。但AlphaFold1的潜力还远没有被开发。于是不久之后,Jumper率领着一个由生物学家、化学家和生物物理学家组成的跨学科团队重新设计了AlphaFold算法。Hassabis、Jumper和AlphaFold团队集思广益,对算法进行了微调,以确保AlphaFold2能高效地学习。在2020年举行的下一届CASP竞赛中,AlphaFold2以惊人的精确度震惊了与会者:AlphaFold2在所有目标的总分中位数达到92.4 GDT。这种精确度可与实验技术相媲美,平均误差仅相当于一个原子的宽度。随后在2021年,DeepMind与欧洲分子生物学实验室的欧洲生物信息学研究所合作,公布了AlphaFold的源代码及其令人印象深刻的35万个蛋白质数据库。现在,该数据库中的蛋白质结构数量已增至2亿多个。Hassabis、Jumper和他们的团队解决了一个困扰科学家半个世纪的难题。AlphaFold这一人工智能工具,开创了研究蛋白质以了解生物功能和指导药物开发的新时代。人工智能技术的进步从根本上改变了科学家解决问题的方式。
拉斯克奖的其他获奖者
今年的拉斯克奖设立了3个奖项:基础医学研究奖、临床医学研究奖,以及医学科学特别成就奖临床医学研究奖授予来自麻省理工学院James G. Fujimoto和Eric A. Swanson,以俄勒冈健康与科学大学Casey眼科研究所及David Huang。 他们发明的光学相干层析成像(optical coherence tomography, OCT)技术能够快速检测并治疗损害视力的视网膜疾病,彻底改变了眼科学。甚至,在马老板的Neuralink推出的脑机接口的植入机器人R1中,也采用了OCT技术。
他们发明的光学相干层析成像(optical coherence tomography, OCT)技术能够快速检测并治疗损害视力的视网膜疾病,彻底改变了眼科学。甚至,在马老板的Neuralink推出的脑机接口的植入机器人R1中,也采用了OCT技术。 OCT机器的起源始于詹姆斯·藤本博士(James Fujimoto)的实验室,他受到高速摄影和激光技术进步的启发,开始开发潜在的方法,使医生能够更好地了解人体内部发生的情况。20世纪80年代末,藤本实验室一位名叫David Huang的博士研究生开始研究这个问题。他成功地在一头牛的眼组织中进行了一些测量,但这个过程的效率还不足以满足医生的需求。因此,两位科学家求助于埃里克·斯旺森,他当时正在开发激光通信和光纤网络技术,看看这些技术能否应用到他们的成像想法中。1991年,三人发表了第一篇论文,描述了他们发明的这项技术。自第一篇论文发表以来,OCT已经成长为一个近20亿美元的市场。医生们现在经常使用这项技术来诊断青光眼、糖尿病相关的视力障碍甚至冠状动脉疾病等疾病。藤本说:「对公众健康的影响可能非常大。」「例如,如果能让病人保持视力,病人可以继续开车,这是生活方式的重大改变,也会对生活质量产生影响。」医学科学特别成就奖授予来自阿姆斯特丹荷兰癌症研究所的Piet Borst,以表彰他50年来在多个领域卓越的科学发现、教育、领导事业。
OCT机器的起源始于詹姆斯·藤本博士(James Fujimoto)的实验室,他受到高速摄影和激光技术进步的启发,开始开发潜在的方法,使医生能够更好地了解人体内部发生的情况。20世纪80年代末,藤本实验室一位名叫David Huang的博士研究生开始研究这个问题。他成功地在一头牛的眼组织中进行了一些测量,但这个过程的效率还不足以满足医生的需求。因此,两位科学家求助于埃里克·斯旺森,他当时正在开发激光通信和光纤网络技术,看看这些技术能否应用到他们的成像想法中。1991年,三人发表了第一篇论文,描述了他们发明的这项技术。自第一篇论文发表以来,OCT已经成长为一个近20亿美元的市场。医生们现在经常使用这项技术来诊断青光眼、糖尿病相关的视力障碍甚至冠状动脉疾病等疾病。藤本说:「对公众健康的影响可能非常大。」「例如,如果能让病人保持视力,病人可以继续开车,这是生活方式的重大改变,也会对生活质量产生影响。」医学科学特别成就奖授予来自阿姆斯特丹荷兰癌症研究所的Piet Borst,以表彰他50年来在多个领域卓越的科学发现、教育、领导事业。 在20世纪60年代,他和他的合作者发现了一些基因,这些基因对于理解寄生虫如何在昏睡病等疾病中逃避免疫系统至关重要。在20世纪80年代,Borst开始研究人们对某些化疗产生耐药性的遗传原因,这些化疗抑制了向患者输送癌症药物的能力。他在这一领域的发现帮助研究人员弄清楚如何更有效地确保化疗对某些癌症有效。这些研究反过来又使人们更好地理解了一种叫做弹性假黄花瘤(PXE)的遗传疾病背后的生物化学原理,这项工作可能有助于开发这种疾病的潜在治疗方法。除了他的科学工作外,拉斯克奖还表彰了Borst在分子病理学研究所、瑞士实验癌症研究所和荷兰癌症研究所中数十年的领导工作。参考资料:https://www.the-scientist.com/news/lasker-award-for-revolutionizing-protein-structure-predictions-71386
在20世纪60年代,他和他的合作者发现了一些基因,这些基因对于理解寄生虫如何在昏睡病等疾病中逃避免疫系统至关重要。在20世纪80年代,Borst开始研究人们对某些化疗产生耐药性的遗传原因,这些化疗抑制了向患者输送癌症药物的能力。他在这一领域的发现帮助研究人员弄清楚如何更有效地确保化疗对某些癌症有效。这些研究反过来又使人们更好地理解了一种叫做弹性假黄花瘤(PXE)的遗传疾病背后的生物化学原理,这项工作可能有助于开发这种疾病的潜在治疗方法。除了他的科学工作外,拉斯克奖还表彰了Borst在分子病理学研究所、瑞士实验癌症研究所和荷兰癌症研究所中数十年的领导工作。参考资料:https://www.the-scientist.com/news/lasker-award-for-revolutionizing-protein-structure-predictions-71386








 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง





