编译 | 曾全晨
审稿 | 王建民
今天为大家介绍的是来自Giosuè Costa团队的一篇论文。SARS-CoV-2主蛋白(Mpro)是病毒复制的关键酶,被认为是治疗COVID-19的有吸引力的药物靶点。在这项研究中,将虚拟筛选技术和体外实验相结合,从大约8000种FDA批准的药物中筛选出了新型Mpro抑制剂。对接分析突出显示了17个有前景的最佳候选药物,从生物学角度对它们的Mpro抑制活性进行了表征。其中,有7种头孢菌素和口服抗凝药贝曲沙班能够在微摩尔范围内阻断酶活性,且在测试的最高浓度下没有细胞毒性影响。在评估与研究配体结合相关的Mpro残基的保守程度后,评估了这些配体对SARS-CoV-2复制的影响。贝曲沙班影响SARS-CoV-2复制的能力,与其抗血栓作用相关,可能为其在治疗住院COVID-19患者中的可能应用铺平了道路。

2019年12月,一种被定义为严重急性呼吸综合症冠状病毒2型(SARS-CoV-2)的新型病毒迅速传播到世界各地,引发了冠状病毒疾病2019(COVID-19)的爆发。截至2023年1月,已确认感染人数已接近6.3亿,导致了超过六百万人死亡。SARS-CoV-2是一种正链RNA包膜的β冠状病毒,与严重急性呼吸综合症冠状病毒(SARS-CoV)和中东呼吸综合症冠状病毒(MERS-CoV)类似,其基因组编码非结构蛋白(nsp’s),包括主蛋白酶(Mpro,3CLpro),类木瓜蛋白酶(PLpro),螺旋酶(nsp13)和RNA依赖性RNA聚合酶(RdRp)。其中,Mpro是至少12个nsp’s成熟的产物,是病毒生命周期中的关键酶,可以选择性地被抑制,因为其结构和底物与人体蛋白酶不同。从结构上看,SARS-CoV-2 Mpro包含由柔性环连接的三个结构域。结构域I和II是β桶结构域,而结构域III是α螺旋结构域。活性位点的催化双子由半胱氨酸残基(Cys145)和组氨酸残基(His41)表示,其中半胱氨酸充当亲核试剂,组氨酸则充当一般性酸或碱,旨在在16个不同位置裂解病毒RNA翻译的多肽1a(pp1a)和1ab(pp1ab),以产生参与停止病毒装配过程的多个蛋白。虽然所有协同病毒SARS-CoV-2复制的酶都可能是可药物靶点,但主要的努力集中在Mpro上,因为它在蛋白水解过程中的关键作用。
为了实现这一目标,目前已经采用了多种药物发现策略,如虚拟筛选、药物重定位、高通量筛选(HTS)和基于结构的药物设计,以寻找针对SARS-CoV-2的Mpro的有希望的抑制剂。因此,许多已上市的药物和其他结构多样的合成和天然化合物都被证明是有效的SARS-CoV-2 Mpro抑制剂。例如,多个引导性Mpro抑制剂,如博西普韦(一种HCV丝氨酸蛋白酶抑制剂)、SDZ-224015(一种研究性半胱氨酸蛋白酶-1抑制剂)和GC-376(一种协同抑制剂,用于小肠病毒、诺如病毒和冠状病毒),是通过高通量(HTS)抑制实验产生的。同样,一些在体内和体外具有高效性的Mpro抑制剂,如PF-00835231和PF-07304814、N3和α-酮酰胺,是通过应用全新开发方案而脱颖而出的,现在,由于详细的Mpro结构信息以及与已报告的SARS-CoV和MERS-CoV Mpro抑制剂的构效关系(SAR)研究,这些方案的开展速度更快、更容易。到目前为止,作为Mpro抑制剂在临床使用的唯一化合物是PF-07321332(尼尔马替韦),这是一种可逆共价抑制剂,口服给药。它可以提供约90%的保护,防止严重的COVID-19,并且即使在Mpro基因上出现了进化性突变的情况下,其抗病毒效力似乎也没有受到影响。尽管有关全新开发的上述成功案例,但所需的时间和成本仍然对于跟上过去三年中流行病紧急情况造成了不利影响。因此,已批准或正在研究中的药物的药物重定位仍然是一种策略,用于快速识别、表征和开发抗病毒治疗方法。事实上,抗病毒药物瑞德西韦(一种核苷酸GS-441524的单磷酰胺前药,已知可用于治疗埃博拉病毒感染)和莫纳匹韦(核苷类似物β-D-N4-羟基胞苷的前药,最初用于对抗流感等不同的RNA病毒)被研究为SARS-CoV-2 RNA依赖性RNA聚合酶(RdRp)抑制剂,并且是唯一一种在临床中使用的抗病毒药物。这些广谱抗病毒药物能够减缓COVID-19的发展以及相关临床症状,同时显著减少康复时间。然而,对于未接种疫苗或免疫功能受损的患者,仍然需要有效的治疗方法,这些患者可能无法完全对疫苗产生反应,并且可能会由于病毒突变引发的疫苗逃逸而出现问题。
在研究中,作者采用了一种体外药物重定位方法,通过筛选8000多种已批准和正在研究的美国食品和药物管理局(FDA)化合物,然后实验中验证了最有前途的药物。
药物重定位
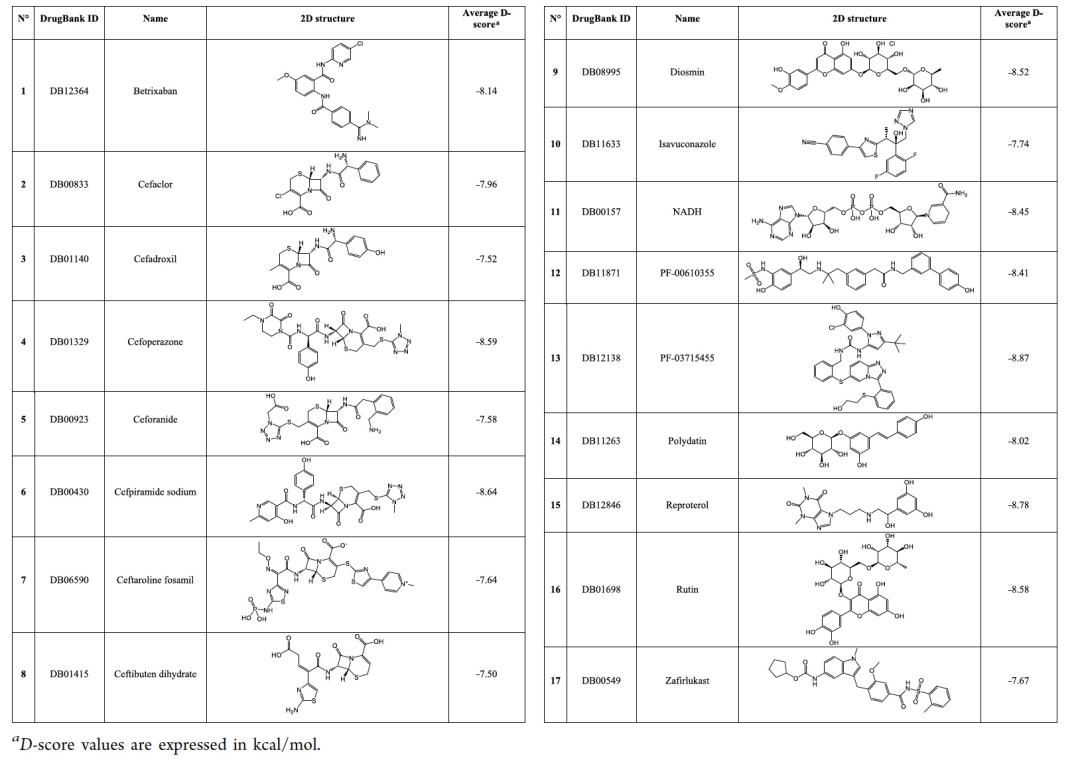
表1
从Protein Data Bank(PDB)中的PDB代码6Y2G中的Mpro晶体结构开始,作者进行了分子动力学模拟(MDs),以探索Mpro结合位点可能发生的所有构象变化。然后根据均方根偏差(RMSD)对整个轨迹进行了聚类,从而获得了四个代表性的结构。为了确定有前途的抑制剂,作者通过对已获得的四个SARS-CoV-2 Mpro聚类进行结构基虚拟筛选,采用了一种药物再利用方法,对FDA批准和正在研究的药物进行了筛选。根据它们的平均Glide对接得分(D-score)排名,该得分是四个聚类的一致性值,作者最终选择了表1中报告的17个最佳命中物。
候选药物对SARS-CoV-2 Mpro在FRET测定中的影响
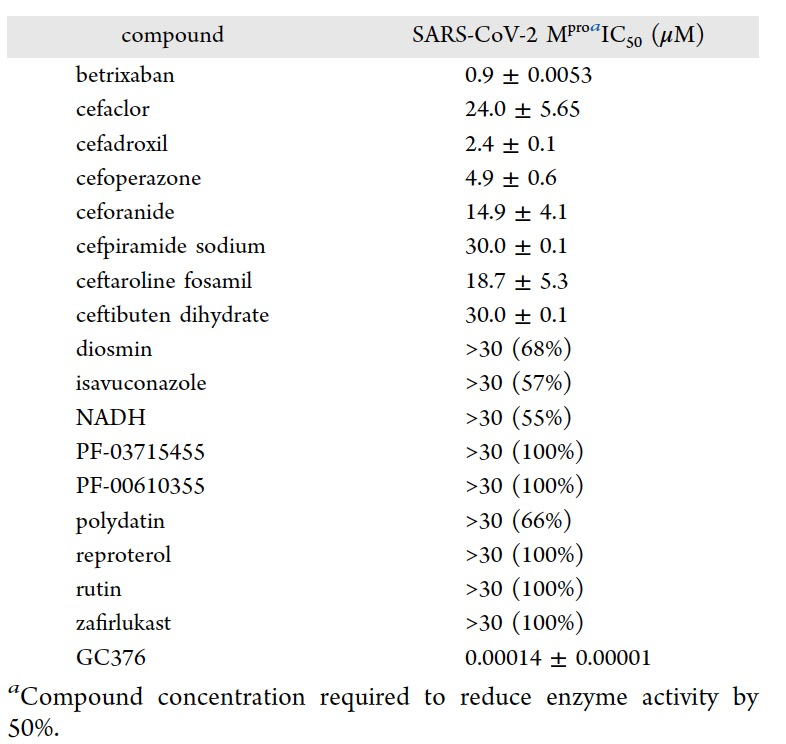
表 2
这17个最佳候选药物在生化测定中测试它们对SARS-CoV-2 Mpro的抑制性能。虽然其中一些化合物表现出不活性,但作者发现其中一些化合物能够以微摩尔级别的IC50值抑制SARS-CoV-2 Mpro。特别是,两种化合物,cefpiramide sodium和ceftibuten dehydrate,显示出约30 μM的IC50值,而ceforanide、ceftaroline fosamil和cefaclor在14.9−24 μM范围内抑制了SARS-CoV-2 Mpro(表2)。此外,cefadroxil和cefoperazone以低微摩尔范围(2.4−4.9 μM)的IC50值阻断了Mpro蛋白酶活性。值得注意的是,betrixaban能够以亚微摩尔的IC50值阻碍Mpro的体外酶活性(表2)。
分析体外酶活性测定的结果,可以注意到最有趣的化合物属于头孢菌素药物和口服抗凝药物类别。头孢菌素是广泛用于抗菌治疗的β-内酰胺类药物,但已经证明它们还可以抑制其他类别的亲核酶。最近,Malla等人获得了一些青霉素衍生物作为强效Mpro抑制剂,并通过质谱和晶体学分析阐明了它们的机制,该机制涉及与亲核半胱氨酸反应以形成稳定的酰酶。所有这些数据都促使作者研究β-内酰胺类药物,特别是头孢菌素药物,用于其他治疗适应症,包括COVID-19和其他病毒性疾病的治疗。Betrixaban通过竞争性和直接抑制丝氨酸蛋白酶Xa,从而阻止了从凝血酶原到凝血酶的转化,进而破坏了凝血级联反应。此外,与Xa因子的其他抑制剂(例如apixaban和rivaroxaban)一样,已经研究了betrixaban对冠状病毒,包括SARS-CoV-2的潜在抗病毒活性,从而支持了作者的发现。
与Mpro结合的活性化合物
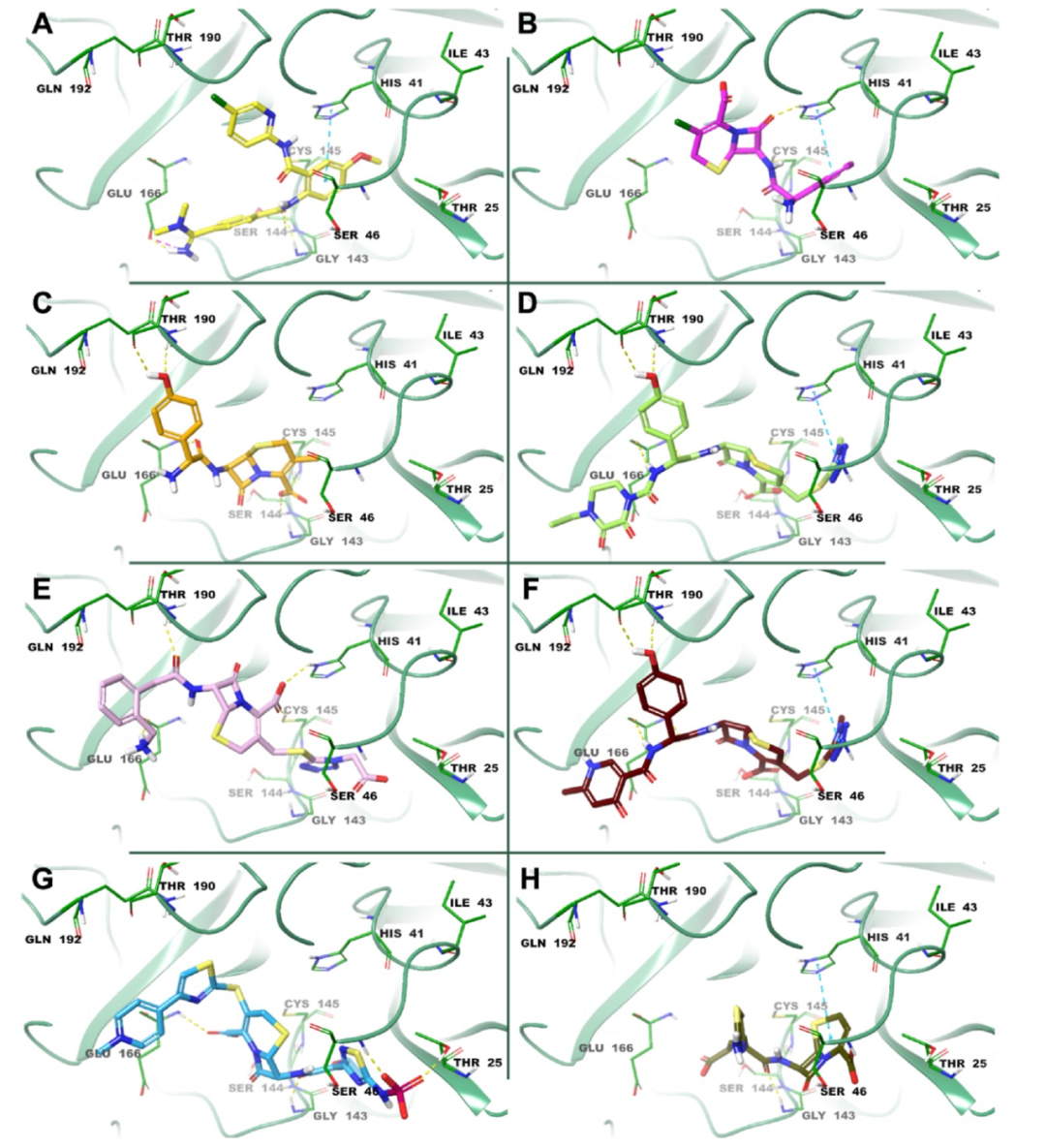
图 1
通过分析最佳候选化合物betrixaban、cefaclor、cefadroxil、cefoperazone、ceforanide、cefpiramide sodium、ceftaroline fosamil和ceftibuten dihydrate与SARS-CoV-2 Mpro的最具代表性的受体结构复合物的结合方式,作者察到所有化合物都与酶的三个底物结合位点(S1、S2和S4)发生了有利的相互作用。具体来说,如图1A所示,betrixaban与Gly143、Ser144和催化Cys145发生了3个关键的氢键(HB)。该配体通过与His41的π−π层叠相互作用以及与Glu166的氢键和盐桥相互作用进一步稳定,这对于保持S1口袋的正确形状和酶的活性构象至关重要。至于cefaclor的结合模式,其β-内酯环的氧原子与位于位置41的组氨酸结合,还与药物的苯环发生π−π层叠相互作用(图1B),而cefadroxil和cefoperazone,这两种广谱抗生素,用于治疗呼吸道感染、腹膜炎、皮肤感染、子宫内膜炎和细菌败血症等多种感染症。此外,cefadroxil和cefoperazone的酚羟基团分别与Thr190和Gln192建立了2个氢键。Cefoperazone通过其四氮唑环与位于位置41的组氨酸之间的π−π层叠相互作用进一步稳定,而cefadroxil则与Ser144建立了额外的氢键(图1C、D)。如图1E所示,seforanide是一种半合成的二代头孢菌素,与Thr26、His41、Cys145、Glu166和Gln192发生氢键相互作用,而cefpiramide sodium,一种用于对抗铜绿假单胞菌并具有广谱抗菌活性的三代头孢菌素抗生素,与Cys145、Glu166和Thr190发生多个氢键相互作用。该化合物还通过其四氮唑环与His41之间的π−π层叠相互作用进一步稳定(图1F)。Ceftaroline fosamil是一种用于治疗社区获得性细菌性肺炎的高级别母体头孢菌素,与Thr25、Ser46、Gly143和Glu166发生4个氢键相互作用(图1G),而头孢地那通常用于治疗慢性支气管炎急性细菌性恶化、急性细菌性中耳炎、咽炎和扁桃体炎,与Gly143发生氢键,并与His41发生π−π层叠相互作用(图1H)。所有分析过的药物还与Leu27、Val42、Met49、Met165、Leu167和Pro168残基发生多个疏水作用,从而增强它们与SARS-CoV-2 Mpro的结合。
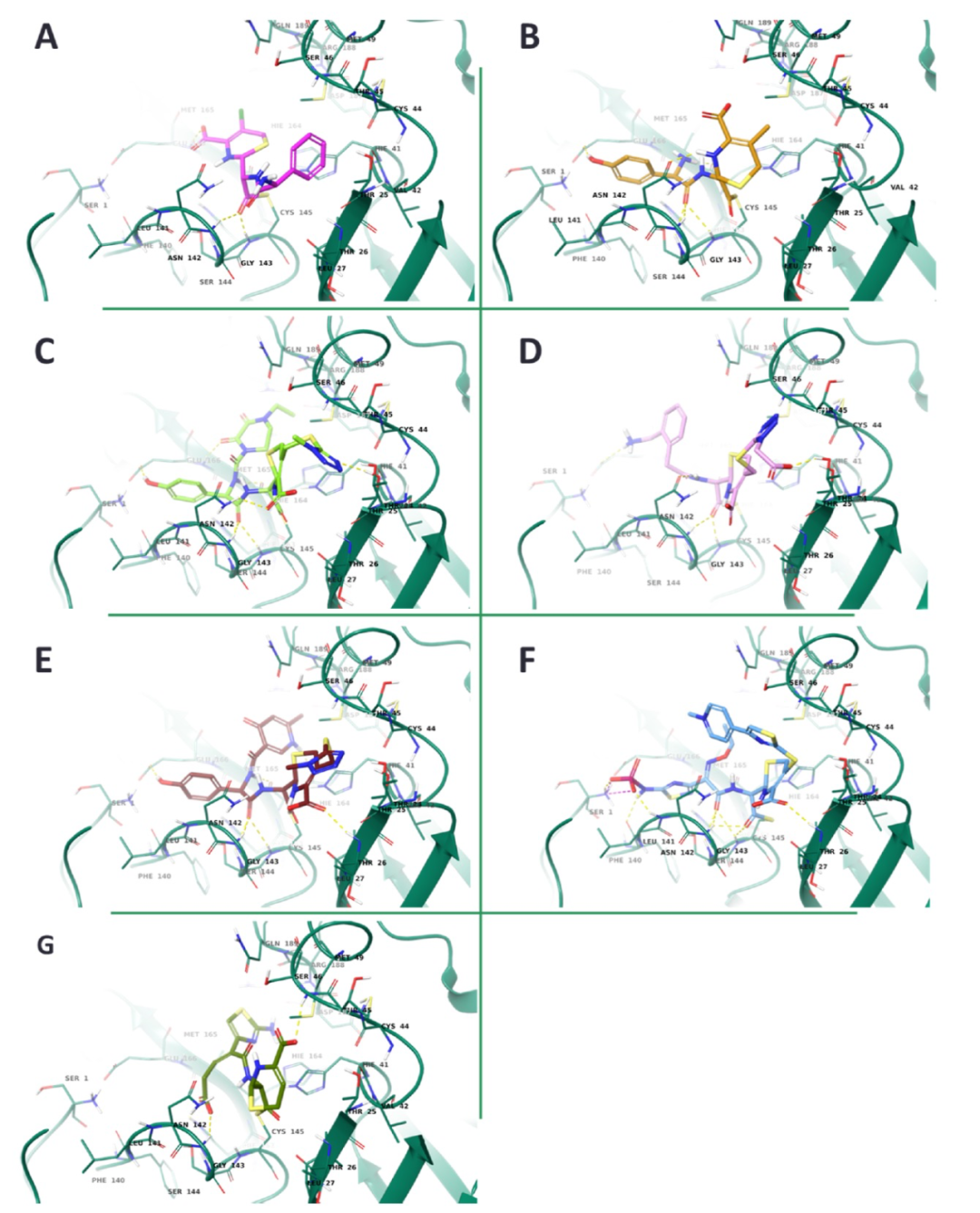
图 2
为了更详细地研究7种头孢菌素类药物与活性位点的结合,作者采用了共价对接策略。如图2所示,所有β-内酰胺类药物的酮羰氧原子与Gly143和Cys145的相互作用。唯一的例外是ceftibuten,其中只有两个羧基团能够与Ser46、Gly143和His163结合。头孢克洛的羧基团通过一个氢键与Glu166相互作用,而头孢他啶则通过4个氢键和与Ser1、Thr26、Phe140和Leu141作用。头孢吡胺与Thr26和His164的背骨原子以及Glu166的侧链形成了3个氢键的相互作用,而头孢克翁与Thr24、Asn142和Glu166发生了相互作用。最后,Mpro的Asn142、His164和Glu166残基负责稳定头孢地尔和头孢哌酮,后者能够与Thr25建立额外的氢键。
活性化合物与Mpro复合物的分子动力学分析
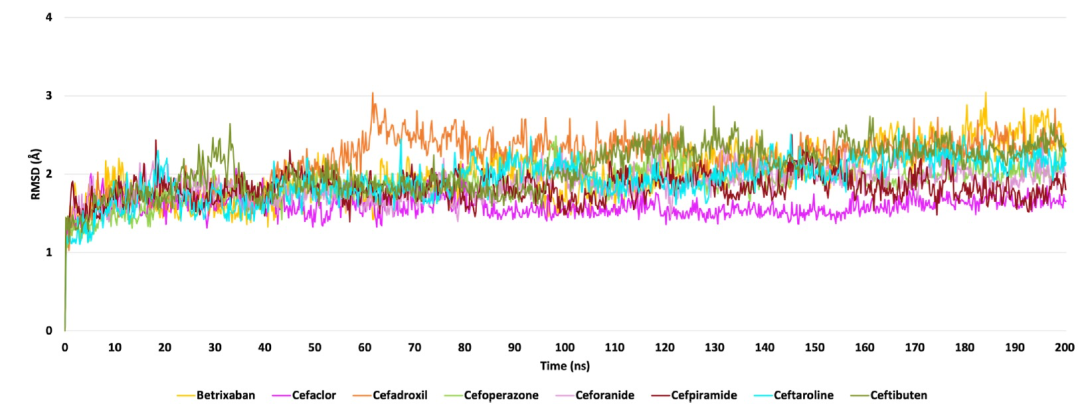
图 3
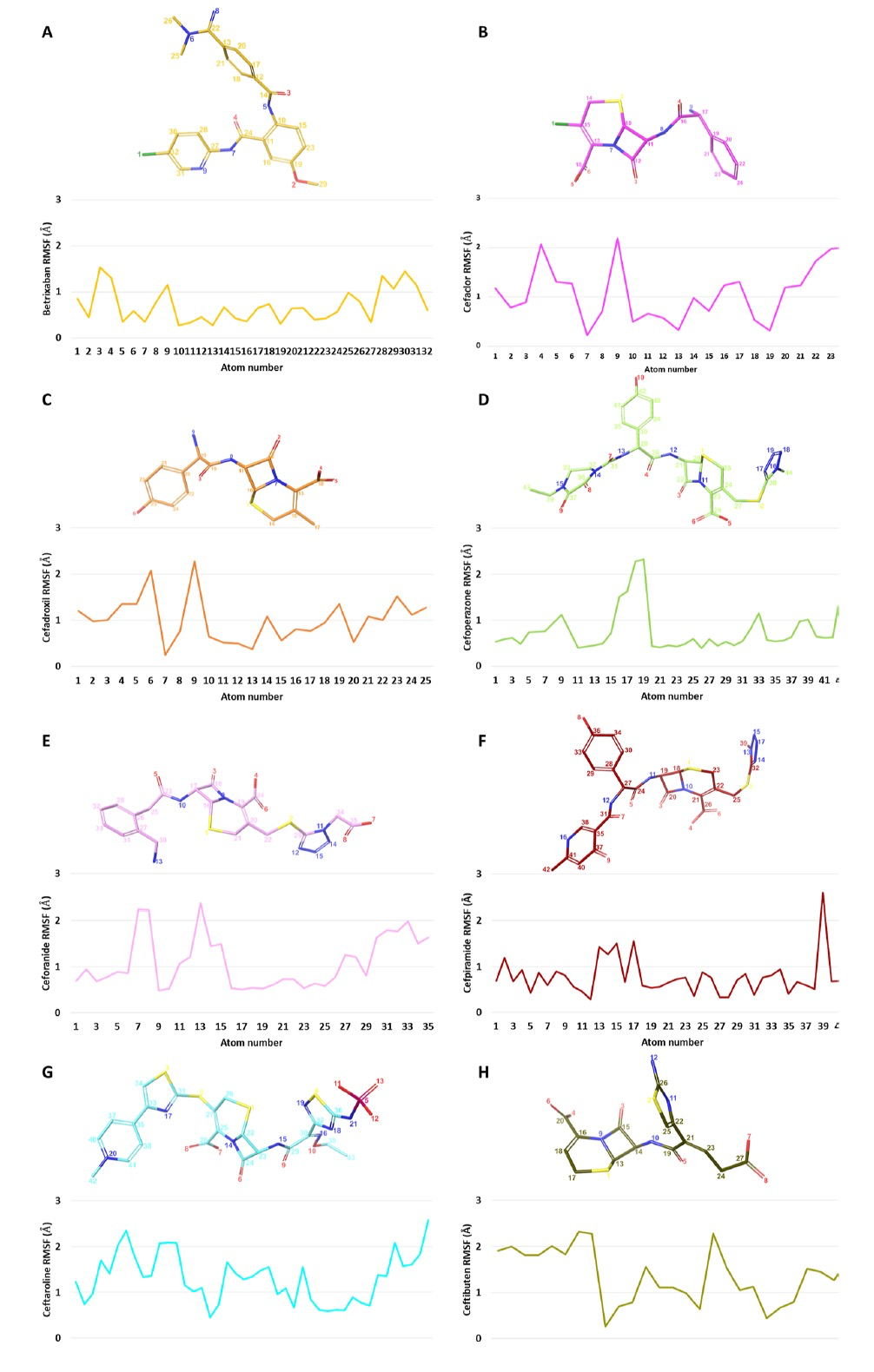
图 4
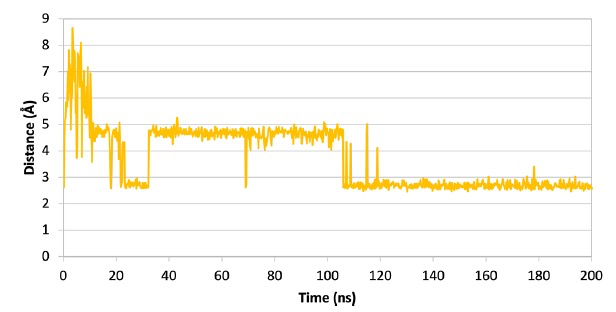
图 5
为了进一步研究配体-Mpro复合物的行为,作者从与SARS-CoV-2 Mpro的最具代表性的受体结构形成的最佳候选物的对接姿态开始进行了200纳秒的分子动力学模拟(MDs)。作者使用Desmond软件进行了MDs。在整个轨迹中,对于每个复合物,计算了蛋白质主链的根均方偏差(RMSD)趋势,如图3所示,发现betrixaban和所有头孢菌素衍生物都能够类似地稳定蛋白质结构。此外,对于每个配体,作者计算了均方根波动(RMSF),以评估整个模拟过程中配体原子位置的变化以及复合物内每个配体的波动 (图4)。波动的一般模式发现,与其他药物相比,betrixaban和头孢菌素衍生物的波动略低。具体来说,如图5所示,观察到在模拟的后半段,Mpro Glu166羧基氧原子与betrixaban carbamimidoyl基团的质子化氮原子之间的距离始终保持在3埃以下。抗凝剂在Mpro结合口袋内的较低RMSF趋势可以通过其在MDs期间能够与Glu166保持这个关键的盐桥相互作用来解释,从而在复合物的稳定中提供了显著的静电贡献。
保守性分析
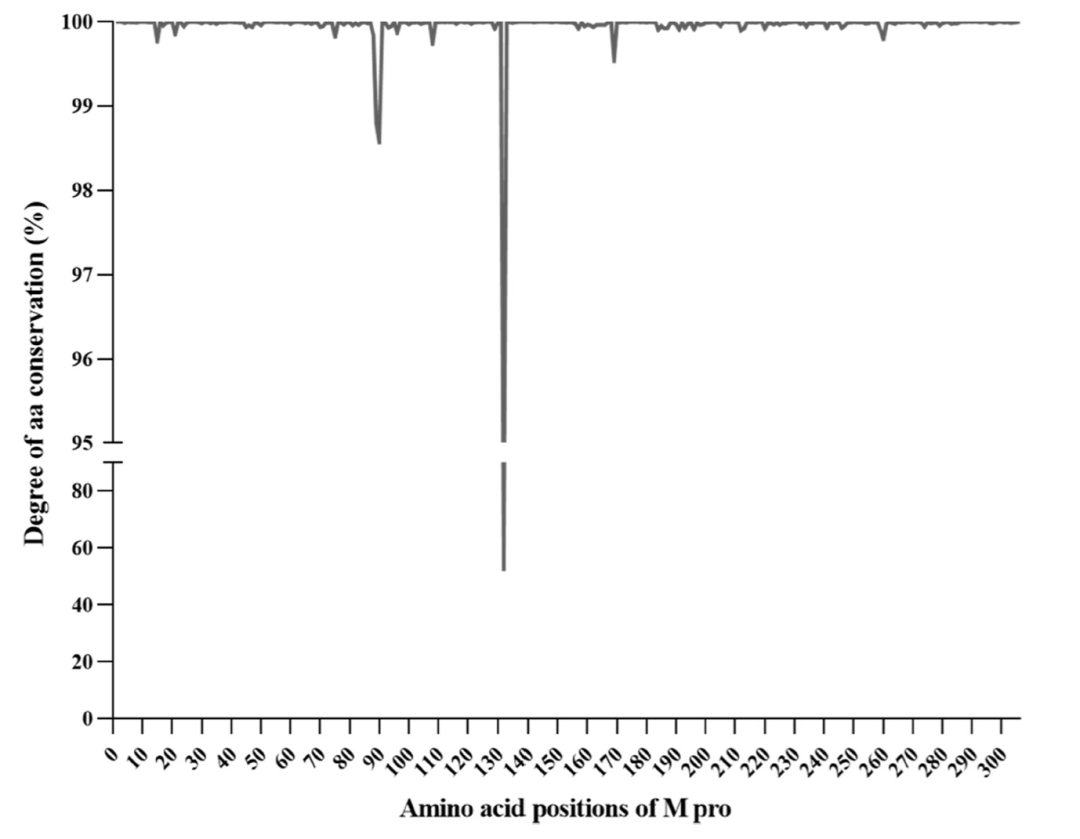
图 6
SARS-CoV-2 Mpro残基的保守性分析和详细研究至关重要。作者对整个Mpro进行了全面的分析。分析显示整个Mpro具有极高的保守性。值得注意的是,62.4%(191/306)的残基从未发生突变,36.6%(112/306)的残基在分析的序列中保守度超过99.5%(图6)。在其余的三个残基中,两个(在89号和90号残基处)表现出相当高的保守性,超过98.5%(图6),其中突变Leu89Phe和Lys90Arg仅在早期变异体Beta和Delta中检测到。只有一个位于位置132的残基在47.5%的序列中经常发生突变,主要是由于Pro132His的出现,该突变特征性地出现在奥密克戎变异体,包括目前正在流行的亚变体BQ.x和BF.x。相反,在以前流行的变异体中从未检测到这种突变。重要的是要注意,Pro132His位于催化区域(位于44和145号残基处)和二聚化区域(位于301−306号残基处)之间的区域,不会对活性位点造成直接的结构变化。在2022年初,在奥密克戎变异体激增期间,一项研究显示Pro132His导致Mpro的热稳定性降低,但不会损害其催化活性或小分子药物抑制。值得注意的是,与Paxlovid耐药性相关的166号残基在分析的序列中保守度极高,超过99.9%,在约5200个序列中检测到了突变(主要是Glu166Gln)。更重要的是,将保守性分析重点放在对所测试化合物的有效结合至关重要的50个残基上(aa: 19−28; 39−49; 117−120; 140−145; 163−172; 181和186−193),作者发现其中60%(30/50)的残基从未突变,而40%(20/50)的残基在分析的序列中保守度超过99.5%。这些数据再次支持了Mpro在其催化活性至关重要的区域,以及在这项研究中出现的抗病毒化合物的结合位点,具有极高的保守性,因此强化了Mpro作为抗病毒药物的有吸引力的靶点的角色,具有广谱活性,可以抵御所有SARS-CoV-2变异体。
SARS-CoV-2复制实验的候选药物
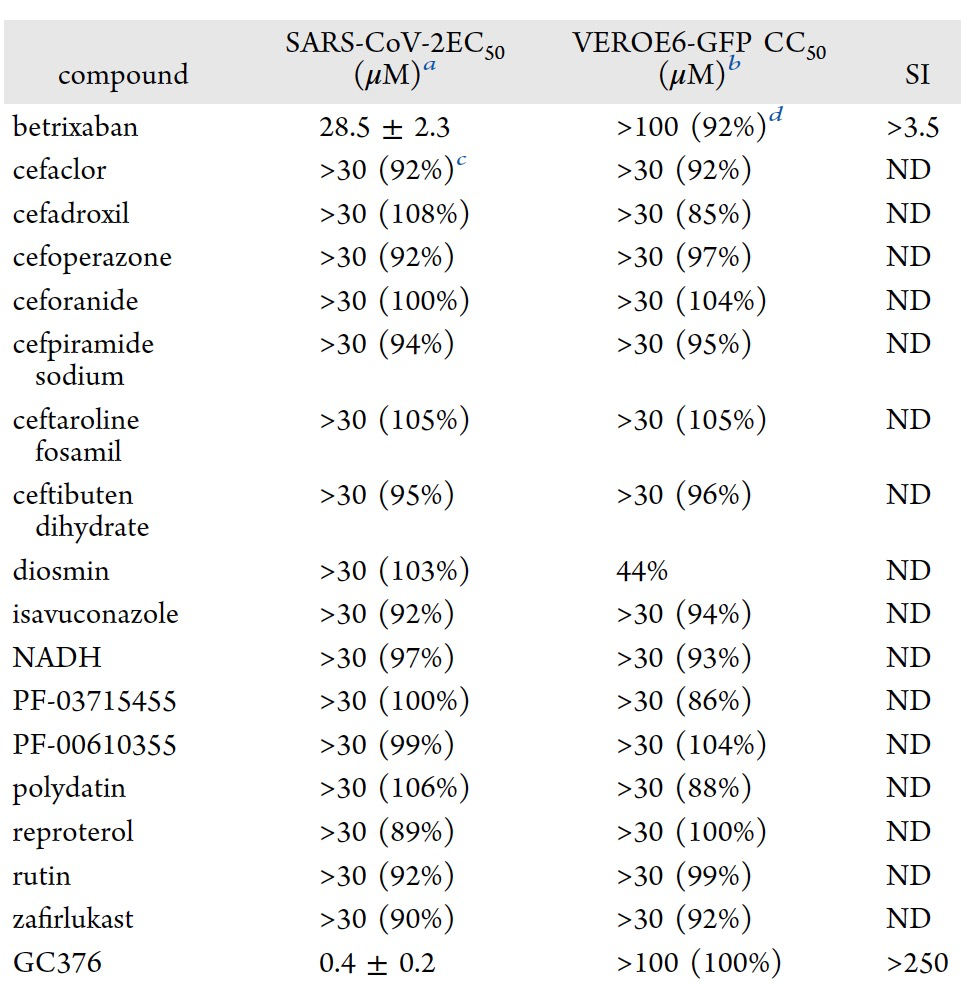
表 3
作者对细胞基因药物测定中对最有前途的化合物对SARS-CoV-2复制的影响进行了体外评估,浓度为30 μM。在17种化合物中,betrixaban能够显著减少病毒诱导的细胞病变效应,EC50为28.5 ± 2 μM,并且在最高浓度下未观察到细胞毒性(表3)。由于过度炎症、内皮细胞激活和损伤、血小板激活和高凝状态引起,COVID-19在感染患者中引发血栓和血栓栓塞性事件。无论年龄如何,这种复杂的情况,称为与COVID-19相关的凝血病(CoAC)。实际上,CoAC增加了患有急性呼吸窘迫综合症的患者的发病率和死亡率。作者的研究结果突出显示,betrixaban能够阻止SARS-CoV-2的复制,这一结果特别重要,因为betrixaban已获批用于住院医学患者的抗凝血治疗,因其能够显著降低无症状和有症状的静脉血栓栓塞(VTE)和VTE相关的死亡率。此外,betrixaban具有重要的抗凝血作用,在严重肾功能不全患者中没有禁忌症,而且不容易发生药物相互作用。
结论
在这里,作者提出了一个成功的体外药物再利用方法的示例,该方法在FDA批准和正在研究的药物中鉴定出了8个有前途的Mpro抑制剂。实际上,在17个预测的最佳命中物中,有7个头孢菌素以微摩尔范围内抑制了Mpro活性(成功率为47%),而最有效的化合物口服抗凝剂betrixaban也能以亚微摩尔范围内抑制病毒复制。
参考资料
Ambrosio, F. A., Costa, G., Romeo, I., Esposito, F., Alkhatib, M., Salpini, R., … & Artese, A. (2023). Targeting SARS-CoV-2 Main Protease: A Successful Story Guided by an In Silico Drug Repurposing Approach. Journal of Chemical Information and Modeling.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


