编译 | 曾全晨
审稿 | 王建民
今天为大家介绍的是来自 Guoxin Li和Ruijiang Li团队的一篇论文。目前研究人员已经在利用深度学习进行医学图像中的癌症检测和诊断方面取得了实质性的进展。然而,在治疗反应和预后的预测方面取得的成功有限。目前基于数据驱动的深度学习模型在临床转化方面存在一个重要障碍,即缺乏解释性,这通常是由于与潜在的病理生物学之间存在脱节所致。在这里,作者提出了一种生物学引导的深度学习方法,可以同时从医学图像中预测肿瘤免疫和基质微环境状态以及治疗预后。

人工智能,包括机器学习和深度学习,正越来越多地用于从生物医学数据中提取信息并发现新的模式。这些方法在推进癌症研究和临床护理方面具有巨大的潜力。深度学习最成功的应用之一是在医学图像中进行癌症筛查,以进行早期检测和诊断。然而,在使用深度学习来预测治疗反应和预后方面的进展较慢,这对于个体化治疗策略具有重要意义。解释性对于高风险临床应用(如治疗决策)至关重要。目前,深度学习领域主要由数据驱动的范式主导,这导致模型在其预测背后缺乏直观的理解或清晰的推理。这一现象加剧了疾病生物学的先前知识在模型开发过程中被忽视的事实。与生物学的脱节导致了模型缺乏解释性,这是临床转化的一个重要障碍。因此需要将病理生物学纳入深度学习模型的设计中,以增强解释性。
肿瘤微环境(TME)由多种免疫和基质细胞类型组成,它们之间紧密相互作用,对肿瘤的控制或进展起着贡献。TME的预后相关性及其对治疗反应的影响在人类肿瘤中已有充分的证据。因此,对TME的评估可以提供有价值的预后和预测信息。然而,当前的基于组织病理学方法容易出现采样偏差。另一方面,成像技术允许对整个肿瘤进行无创性表征,并且可以在整个治疗过程中进行重复。定量成像分析可以揭示放射学表型与潜在病理生物学之间的联系。
研究设计与患者特征
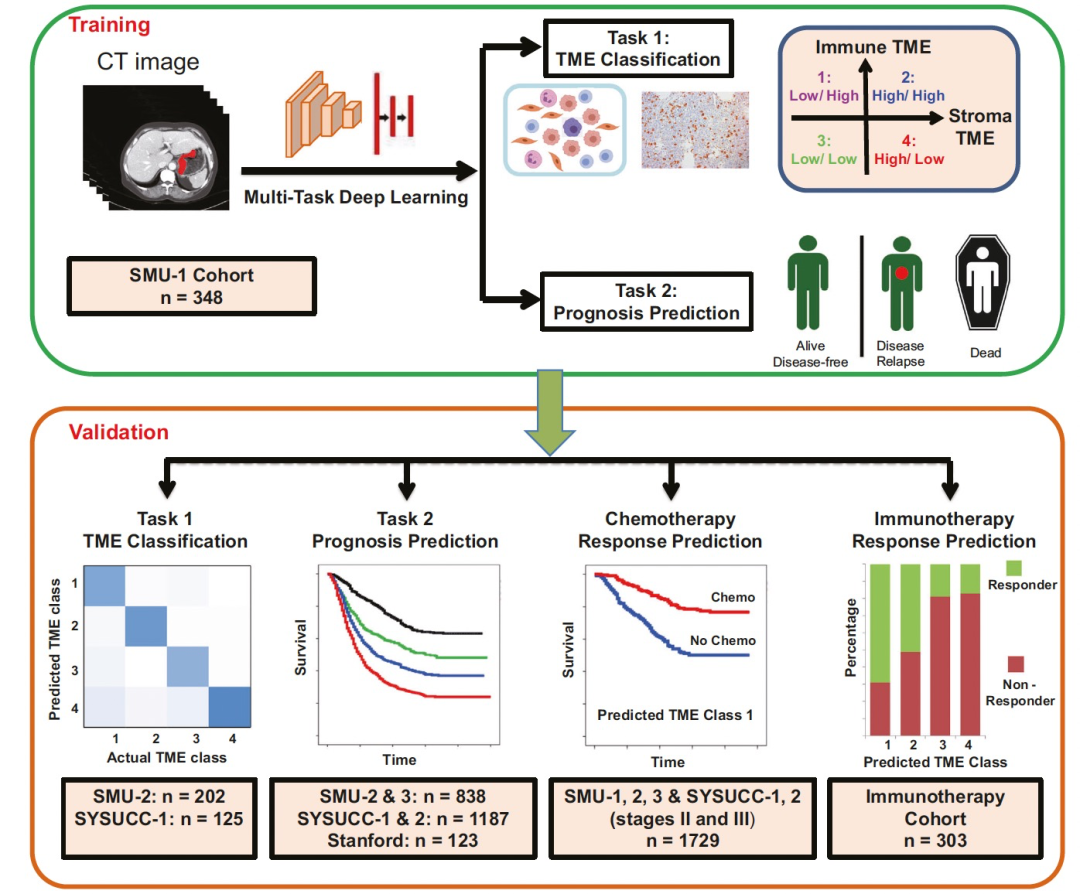
图 1
整体研究设计如图1所示。作者训练了一个深度学习模型,并验证了该模型,该模型使用诊断性CT图像对胃癌患者的TME进行分类和预测预后。将TME和预后预测结合在一个单一模型中的理由是,鉴于两者之间已建立的机制联系,它们是密切相关且相互连接的任务。作者假设这种方法可以提高泛化能力,并带来增强的可解释性。作者测试了该模型在预测非转移性疾病的辅助化疗效益以及预测晚期胃癌的免疫疗法反应方面的能力。作者从中国和美国的四家学术医疗中心招募了患者。总共有2799名患者符合纳入标准,并被分成7个队列。其中,在6个队列中有2496名患者接受了手术治疗,部分接受了辅助化疗。其中大部分患者(1806例,占72.36%)患有II期或III期疾病,有928例(占51.38%)患者接受了辅助化疗。在第7个队列中纳入了接受抗PD-1免疫疗法的303名患者。
生物学引导的深度学习(BgDL)模型的开发
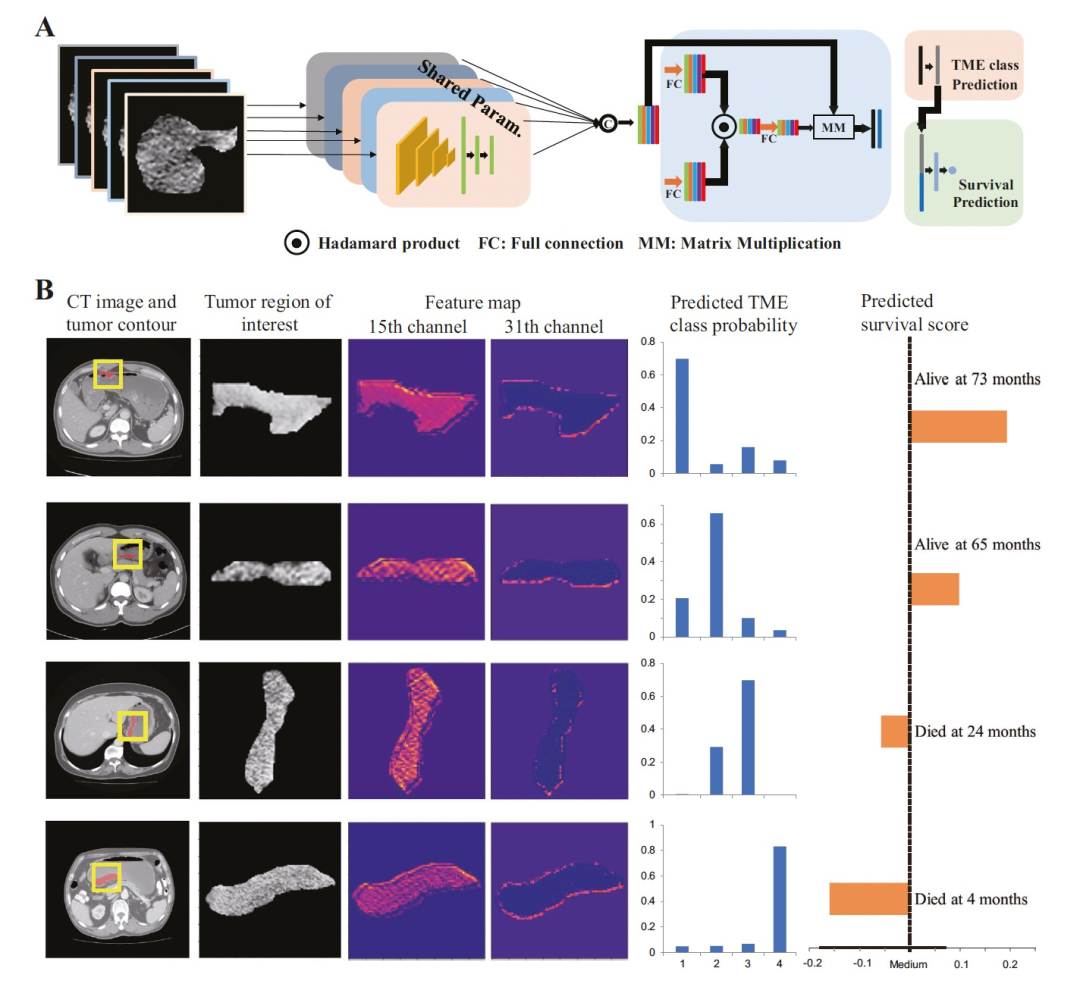
图 2
作者基于CT图像训练了一个多任务深度卷积神经网络模型,同时对TME状态进行分类并预测预后(图2A)。图2B显示了CT图像和相应的特征图,以及四个代表性病例的预测TME类别和生存评分。从视觉上看,特征图似乎与肿瘤的异质性和浸润边缘的成像特征相关。为了理解特征图代表的信息类型,作者使用PyRadiomics包在第15个通道中基于特征图计算了放射组学特征。可以观察到四个TME类别之间的纹理特征值存在显著差异。通常情况下,衡量异质性的特征从TME类别1到4显示递增的模式,而衡量均质性的特征显示出递减的模式。这表明深度学习模型可能捕捉到与肿瘤内部异质性相关的重要信息。
BgDL模型准确地分类肿瘤免疫和基质微环境
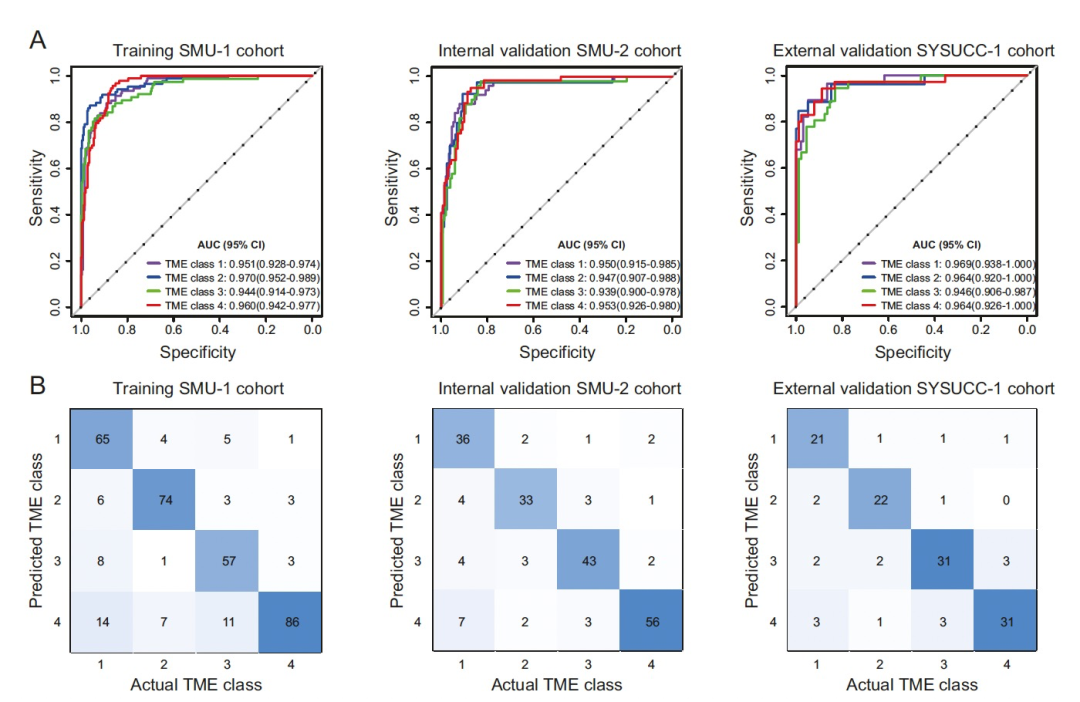
图 3
作者所提出的深度学习模型在训练队列中对四个TME类别进行分类取得了高准确性(图3A)。该模型在内部和外部验证队列中的AUC分别为0.94-0.96和0.94-0.97,显示出相似高水平的区分能力(图3A)。特异度和阴性预测值均在90%以上,而敏感度和阳性预测值在验证队列中变化从70-93%到80-88%。一致地,混淆矩阵显示模型的预测与由IHC定义的实际TME类别相符(图3B)。四个TME类别的整体准确率在训练和两个验证队列中分别约为0.810(95% CI:0.769–0.851)、0.832(0.780–0.884)和0.840(0.776–0.904)。
BgDL模型预测预后
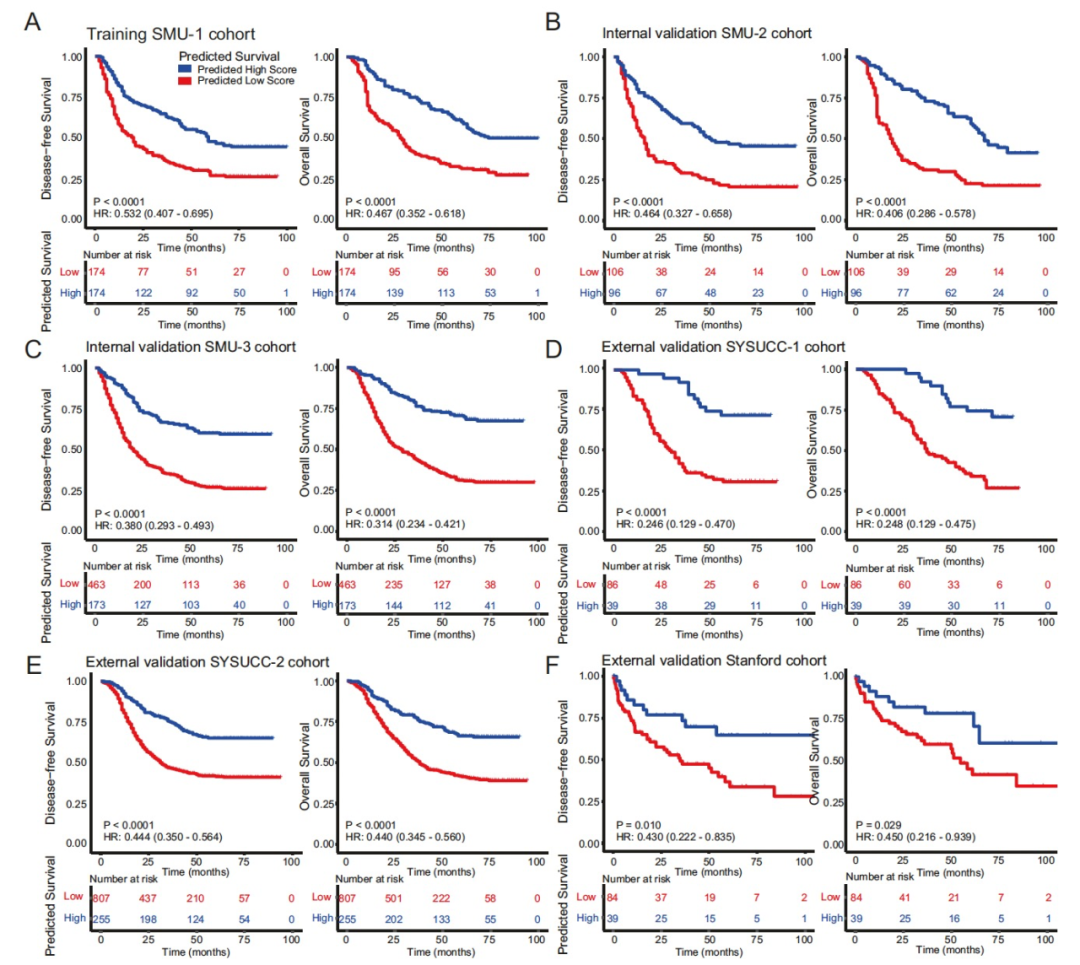
图 4
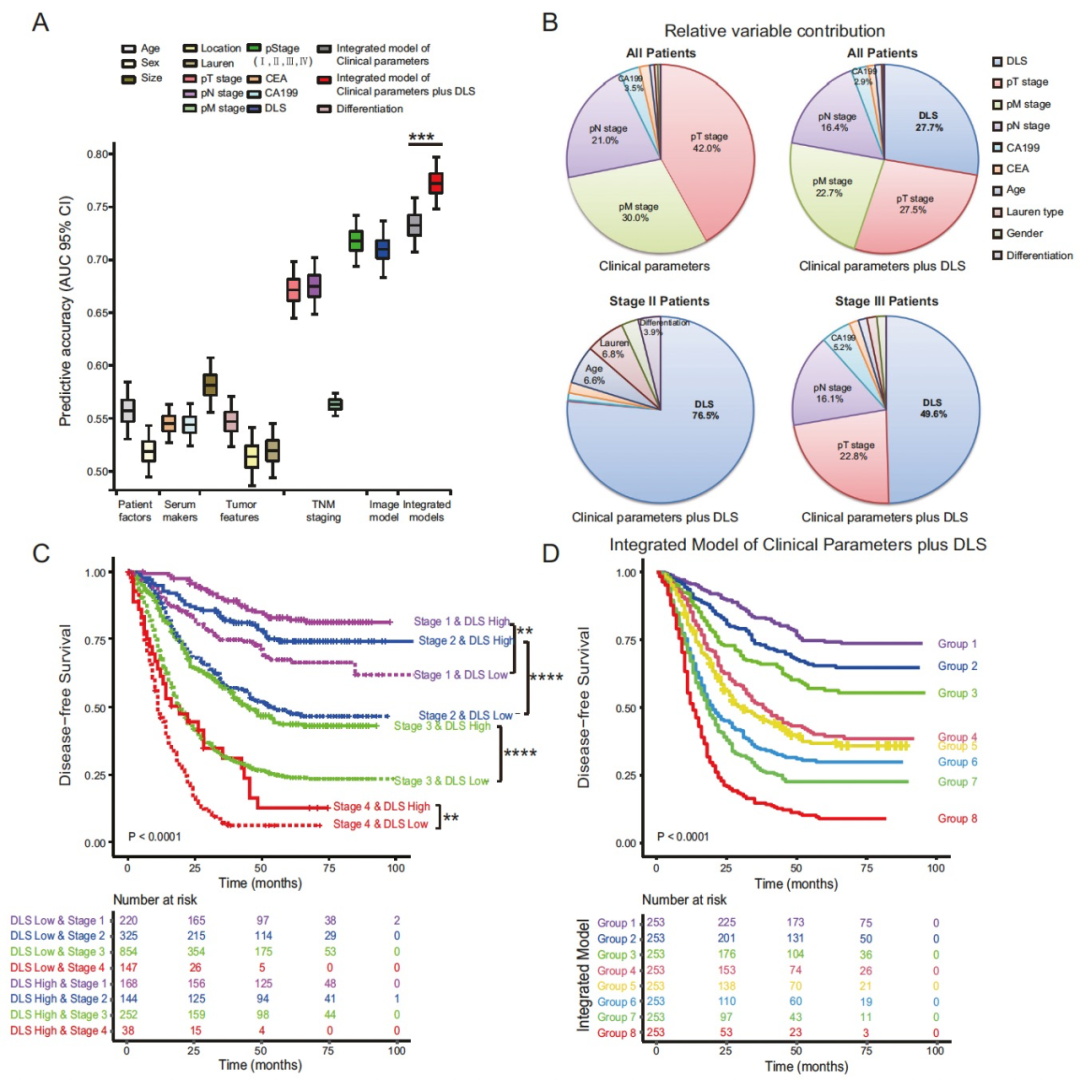
图 5
基于BgDL模型预测的生存评分,作者使用训练队列中的中位数值将患者分为两组,然后将相同的分割点应用于所有验证队列。在训练队列中,可以观察到低得分组与高得分组之间的DFS(无疾病存活)和OS(整体存活)均存在显著差异(图4A)。高风险患者的5年DFS和OS率分别为19.83%和20.66%,而低风险患者的率分别为43.61%和54.63%(图4A)。在所有5个独立的验证队列中,模型预测的生存评分与预后之间的相同模式一致存在(图4B-F)。
作者将所提出的深度学习模型的判别能力与传统的临床病理风险因素在预后预测的AUC方面进行了比较。深度学习生存评分(DLS)在几乎所有风险因素中,包括pT、pN、pM分期、肿瘤大小、分化程度等方面,都表现出更优越的可区分性(图5A)。
然后,作者进行了多变量Cox回归分析。在临床病理风险因素中,pT、pM和pN分期是最重要的变量。然而,当将DLS添加到模型中时,它成为预后预测的最重要参数(图5B)。对于II期或III期疾病的患者,DLS是预后预测的主要变量,相对贡献率分别为76.5%和49.6%(图5B)。作者进一步评估了深度学习模型在具有相同临床病理风险因素的每个患者亚组中的预后价值。DLS在所有分期亚组中都显著分层了DFS(图5C)。令人惊讶的是,高DLS的II期患者的总体生存甚至优于低DLS的I期患者;DFS也存在类似的趋势。
结论
在这项工作中,作者开发了一种生物学引导的深度学习方法,允许同时从放射学图像中预测免疫和基质肿瘤微环境(TME)状态以及预后预测。通过多任务学习对预后和肿瘤微环境的同时预测,在一个由2799名患者组成的国际多中心队列中广泛验证了该模型的预后预测。这与先前试图通过显著性或注意力映射来执行“事后”解释的模型形成对比。结果表明,将生物学领域知识作为深度学习的组成部分不仅提高了与传统方法相比的泛化能力,还增强了模型的可解释性。
参考资料
Jiang, Y., Zhang, Z., Wang, W. et al. Biology-guided deep learning predicts prognosis and cancer immunotherapy response. Nat Commun 14, 5135 (2023).
https://doi.org/10.1038/s41467-023-40890-x




 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง





