
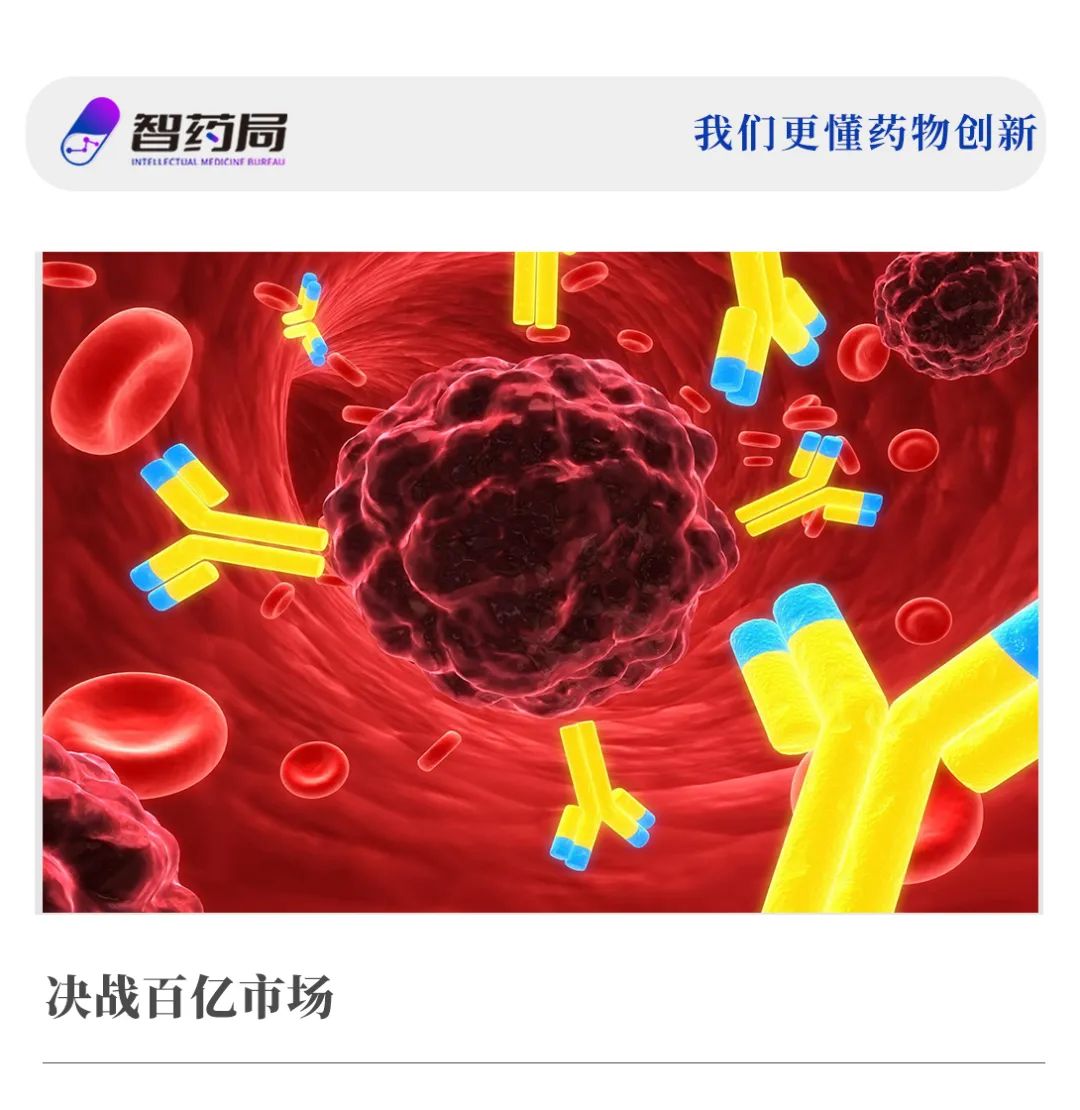
据智药局监测,2023年第三季度,全球至少共有24款ADC药物取得临床申报进展,国产至少占据20款。其中有7项IND获得受理,20项获批IND即将进入临床。
在这些ADC药物中,虽有HER2扎堆的现状出现,但也有部分药企开始拓展差异化的新型靶点,多款产品属于“首款”新药,具有一定临床意义,有较大的发展潜力,有望出现重磅品种。
例如,此次尚健生物旗下的SG2918,是全球同靶点首个申报临床的ADC药物;应世生物的OMTX705是全球首款靶向成纤维细胞活化蛋白(FAP)的ADC药物。 7项IND受理
7项IND受理
上海生物制品研究所SIBP-A13 IND获得受理
7月7日,中国生物上海生物制品研究所自主研发的首个创新型抗体偶联药物(ADC)SIBP-A13临床试验申请获国家药品监督管理局药品审评中心(CDE)正式受理。
这标志着上海生物制品研究所ADC药物研发已从技术平台创新转入了临床开发的新阶段,具有重要里程碑意义。
多禧生物DXC006 IND获得受理
7月11日,多禧生物递交的DXC006项目IND申报已获国家药品监督管理局药品审评中心(CDE)正式受理,受理号CXSL2300460。
DXC006作为多禧生物申报的第八款ADC药物,适应症为多种实体瘤、血液瘤。
3项BTD认定,科伦博泰SKB264 IND获得受理
7月18日,CDE官网显示,科伦博泰提交的”注射用SKB264″临床试验申请获得受理。
SKB264已获得国家药品监督管理局(NMPA)药品审评中心(CDE)3项突破性疗法认定(BTD),分别用于治疗局部晚期或转移性三阴乳腺癌(TNBC)、EGFR-TKI治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)、既往接受过至少二线系统化疗的局部晚期或转移性激素受体阳性(HR+)和人表皮生长因子受体2阴性(HER2-)的乳腺癌。
全球首个!尚健生物SG2918 IND获得受理
7月31日,尚健生物宣布,其自主研发的首个1类创新ADC药物注射用SG2918临床试验申请获得国家药品监督管理局(NMPA)受理,拟定适应症为恶性肿瘤。
靶点未披露,但新闻稿称该项目是全球同靶点首个申报临床的ADC药物。
非临床研究结果显示,SG2918抗肿瘤活性明确,安全性可控;单药在多种肿瘤模型中发挥显著抗肿瘤活性,并可与抗PD-1抗体联合应用,协同发挥抗肿瘤活性。
首款申报PD-L1 ADC!复宏汉霖两款获得受理
8月17日,据CDE官网显示,复宏汉霖两款1类创新药HLX42、HLX43临床申报获得受理。
HLX42是一款EGFR ADC药物,而HLX43则为PD-L1 ADC,这也是复宏汉霖首次申报ADC新药,成为国内第4家申报EGFR ADC、首家申报PD-L1 ADC的药企。
在此之前,复宏汉霖拥有的 5 款 ADC 新药管线均处于临床前开发阶段,本次受理意味着该公司 ADC 新药进入临床开发的第一步。
阿斯利康AZD5335 IND受理
8月25日,CDE官方显示,阿斯利康提交AZD5335的临床试验获得受理,受理号:JXSL2300158。
AZD5335是由FRα 抗体偶联其专有的 TOP1抑制剂 AZ14170132,DAR为8。

20项IND获批
全球首创!百利天恒BL-B01D1获批IND
7月1日,百利天恒及其子公司SystImmune共同宣布,FDA批准该公司在研药物BL-B01D1的新药申请(IND),用于转移性或不可切除的非小细胞肺癌 (NSCLC)。
BL-B01D1是百利天恒自主研发的全球首创EGFR x HER3双抗ADC药物,也是百利天恒ADC药物管线上第一个获得NMPA临床试验批准的药物。
BL-B01D1已在国内近百家医疗机构开展多项临床试验,治疗领域包含了头颈、胸部、消化道、生殖系统,尤其在非小细胞肺癌的临床数据表现惊艳,展现了具备突破性疗效的有效性。
信达生物IBI354获临床试验默示许可
7月4日,CDE官网显示,信达生物HER2 ADC新药IBI354的临床试验申请获默示许可,用于晚期实体瘤。
IBI354以拓扑异构酶i抑制剂喜树碱衍生物为payload。先前在2022年12月5日,信达生物在clinicaltrials网站上注册了ibi354的1/2期临床试验,此临床主要在欧洲进行。
恒瑞医药SHR-A2009联合治疗获默示许可
7月14日,CDE官网显示,恒瑞医药旗下阿得贝利单抗注射液联合SHR-A2009加或不加化疗治疗晚期实体瘤患者的临床申请获得默示许可。
SHR-A2009是恒瑞自主研发的以HER3为靶点的抗体药物偶联物(ADC)。此前,恒瑞已开展SHR-A2009单药治疗晚期实体瘤的I期临床试验。
恒瑞医药SHR-A1811联合治疗获批临床
7月14日,恒瑞医药称其及子公司盛迪亚生物获得国家药品监督管理局核准签发的《药物临床试验批准通知书》,批准开展一项注射用SHR-A1811联合吡咯替尼等抗肿瘤药物在晚期实体瘤受试者中的安全性、耐受性及有效性的ⅠB/Ⅱ期临床研究。
SHR-A1811是恒瑞医药自主研发的、以HER2为靶点的抗体药物偶联物(ADC),可以通过结合并内吞HER2表达的肿瘤细胞,在肿瘤细胞溶酶体内通过蛋白酶剪切释放毒素,诱导肿瘤细胞凋亡。
次月,SHR-A1811拟纳入突破性治疗品种,用于治疗人表皮生长因子受体2(her2)阳性晚期结直肠癌患者。
迈威生物两款ADC获临床试验默示许可
7月18日,CDE官网最新公示,迈威生物两款1类新药获得临床试验默示许可。
根据迈威生物新闻稿,这两款新药分别为:靶向Trop-2的抗体偶联药物(ADC)以及靶向B7-H3的ADC产品,拟开发适应症均为晚期实体瘤。
信诺维XNW28012获批IND
7月27日,信诺维研发的创新型抗体偶联药物-“XNW28012”的I期临床试验申请获得国家药品监督管理局药品审评中心(CDE)批准,即将在晚期实体瘤患者中开展临床试验。
XNW28012是信诺维第八款临床阶段产品,在临床前研究中,XNW28012已在组织因子(TF)高表达实体瘤模型中显示出良好的抗肿瘤疗效,而且药物整体安全性可控,有望为TF高表达实体瘤患者提供一种新的治疗方式。
信诺维XNW28012在美获批临床
8月11日,信维诺的XNW28012的临床试验申请获得FDA批准,用于治疗实体瘤。
昂阔医药CUSP06在美获批临床
8月15日,昂阔医药宣布其CUSP06项目已获得美国FDA批准启动1期临床试验。
昂阔医药从普众发现引进CUSP06,拥有该产品除大中华区外的全球开发和商业化权益。
CUSP06是一款高度差异化的靶向cadherin-6(CDH6)抗体偶联药物(ADC),具有可针对多种恶性实体肿瘤进行治疗的潜力。
西岭源SMP-656获批IND
8月24日,西岭源药业全资子公司成都科岭源医药技术有限公司自主研发的治疗用生物制品1类新药“注射用SMP-656”,收到国家药品监督管理局(NMPA)批准签发的《药物临床试验批准通知书》。
SMP-656是科岭源基于创新XL-XDC平台自主开发的HER2-ADC,HER2靶点成熟且全球已有3款创新ADC获批上市,因此未来临床开发成功率高。
天士力生物STRO-002获临床试验默示许可
8月24日,CDE官网显示,Sutro Biopharma申请的1类新药STRO-002注射液获得临床试验默示许可,拟开发用于晚期恶性实体瘤。
公开资料显示,STRO-002是一款靶向叶酸受体α(FRα)的抗体偶联药物(ADC),天士力生物通过一项约3.85亿美元的合作获得其中国独家开发和商业化权益。
全球首款!应世生物OMTX705获批IND
8月28日,应世生物宣布,其开发的全球首创抗体偶联毒素(ADC)药物OMTX705已经获得中国国家药品监督管理局(NMPA)颁发的临床研究批件。
OMTX705是全球首款靶向成纤维细胞活化蛋白(fibroblast-activating protein,FAP)的ADC药物,也是应世生物首款进入临床阶段的ADC创新药。拟开发适应症为中国人群高发的多种消化道肿瘤。
和铂医药HBM9033在美获批临床
8月28日,和铂医药发布公告,HBM9033获得FDA批准进行临床试验,用于治疗晚期实体瘤。
HBM9033为一款靶向MSLN的ADC新药,也是和铂医药首款进入临床阶段的ADC新药。HBM9033采用独特设计,Linker血浆中稳定但在肿瘤组织特异性裂解释放payload。
映恩生物DB-1311获临床试验默示许可
8月29日,CDE官网公示,映恩生物申请的1类新药注射用DB-1311获得临床试验默示许可,拟开发用于治疗晚期/转移性实体瘤。
公开资料显示,DB-1311是一款基于映恩生物DITAC技术平台开发的,拓扑异构酶-1抑制剂的抗体偶联药物(ADC)候选药物。BioNTech公司通过一项超16亿美元的合作,获得了包括该产品在内两款ADC的海外权利。
上海生物制品研究所SIBP-A13获批IND
9月18日,中国生物上海生物制品研究所自主研发的创新型抗体偶联药物(ADC)SIBP-A13获得国家药品监督管理局临床试验批准通知书,拟用于在晚期恶性实体瘤患者中开展临床试验。
SIBP-A13是上海生物制品研究所基于国内领先的第3代adc技术研发的靶向her3 adc新药,具有连接子可裂解、载荷活性强、抗肿瘤“旁观者效应”等药物优势。
多禧生物DXC006获批IND
9月20日,据CDE官网,多禧生物DXC006获批临床,拟用于多种实体瘤、血液瘤的研究。
翰森制药HS-20105获批IND
9月25日,翰森制药发布公告,称其附属公司翰森生物及恒邦药业自主研发的Trop-2靶向ADC药物HS-20105已获批临床,拟用于晚期实体瘤的治疗,具体适应症待临床试验后确定。
HS-20105是一种由IgG1亚型人源化抗Trop-2单克隆抗体通过可蛋白酶剪切的linker偶联DNA拓扑异构酶I抑制剂之后形成的抗体药物偶联物(ADC)。
目前,全球范围内仅有一款Trop-2 ADC获批上市,即吉利德旗下的戈沙妥珠单抗。同赛道上,默沙东/科伦博泰的SKB264和阿斯利康/第一三共的Dato-DXd处于较为领先的III期临床阶段。
恒瑞医药SHR-A1912临床试验获批
9月25日,恒瑞医药发布公告,公司子公司上海恒瑞医药有限公司收到国家药品监督管理局核准签发关于注射用SHR-A1912的《药物临床试验批准通知书》,将于近期开展临床试验。将开展联合含利妥昔单抗的治疗方案用于B细胞非霍奇金淋巴瘤的临床试验。
注射用 SHR-A1912 为靶向 CD79b 的抗体药物偶联物(ADC),本品可通过与肿瘤表面的 CD79b 特异性结合,使得药物被内吞进入肿瘤细胞后释放小分子毒素杀伤肿瘤细胞。
Adcentrx获FDA批准开展ADRX-0706临床研究
7月17日,Adcentrx公司宣布,FDA已经批准了该公司关于ADRX-0706用于治疗选择性晚期实体肿瘤的IND申请。
ADRX-0706,一款靶向Nectin-4靶点的ADC新药,是 Adcentrx ADC 技术平台第一个获得美国FDA批准开展临床研究的产品,预计临床 1a/1b 研究将于2023年下半年展开。
Vincerx获FDA批准开展VIP943临床研究
8 月 22,Vincerx Pharma 称该公司已获得FDA的IND申请许可,启动 VIP943 的 1 期临床试验。Vincerx 预计将于 2023 年第四季度初招募第一位患者参加该研究。
VIP943是一种新型ADC,采用Vincerx的下一代ADC技术开发,旨在增强KSPi有效负载(驱动蛋白纺锤体蛋白抑制剂)的细胞内积累,可能导致更高的功效,同时限制不需要的副作用。
VIP943的1期试验旨在评估VIP943在晚期AML和骨髓增生异常综合征(MDS)患者中的安全性、药代动力学/药效学和初步疗效。






 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


