
点击蓝字 关注我们

微末生物
Nanomega BioAI
帕金森病的元凶α-Synuclein
帕金森病是一种中枢神经系统的神经退行性疾病,临床表现为震颤、肌肉强直等运动症状。长期以来,其发病的分子机制蕴藏着很多未解之谜。而随着世界范围内科研工作者的不懈努力,科学家们已经逐步揭开其神秘面纱,抓住了一些重要线索。
在帕金森病的病理表现上,一个关键就是脑部黑质和纹状体区域大量积累了一种神经元重要的结构蛋白——α-Synuclein。这种小蛋白质会从正常可溶状态,聚合成聚集物和有毒性的离型聚合纤维,继而导致神经元损伤。可以说,α-Synuclein的异常聚合过程是帕金森病最根本的发病机制。
更为复杂的是,近年来研究发现α-Synuclein可以以很多种形式进行聚合,形成所谓的多态体(polymorphs)。这些不同形态的聚合物,会在小鼠体内不同脑区传播,诱发不同表型的帕金森病。实验也表明,不同患者体内检测到的α-Synuclein多态体差异很大。
那么问题来了,这些α-Synuclein多态体结构上有何不同之处?它们又是如何互相转化,参与疾病进程的?解读清楚这些问题,对于我们设计药物治疗帕金森病,具有核心指导意义。
双重多态体结构初显真容
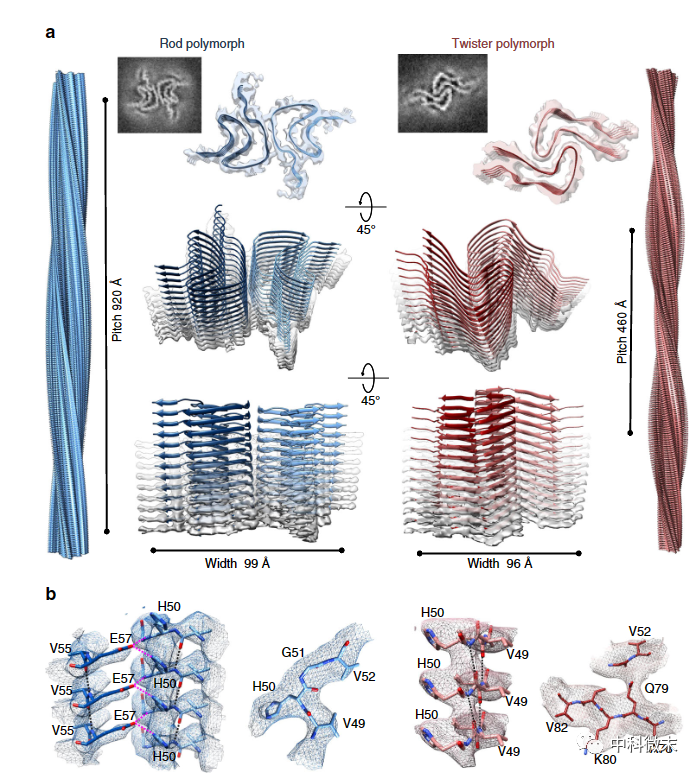
图1 冷冻电镜揭示α-Synuclein的“rod”和“twister”两种多态体模型
为回答α-Synuclein多态体结构生物学方面的问题,来自加州大学洛杉矶分校的周正洪教授团队利用冷冻电镜技术,成功在近原子水平解析了两种主要的α-Synuclein纤维多态体三维结构。这两种多态体被首次命名为“rod”和“twister”。该项研究成果发表在了《自然 通讯》上。
从形态上看,rod多态体整体笔直延伸;而twister多态体带有明显的右手性螺旋扭曲。当科研人员详细比较两种多态体结构时,惊奇地发现它们的基本组成模块是高度同源的,都由两个交织的亚基通过蛋白质链的旋转形成,这种堆叠方式形成了一个由β片层扭曲折叠组成的共同内核。
那么rod和twister多态体的差异在哪里呢?主要就在于这些共同内核单元之间的堆积方式。简单来说,就是同源亚基之间的相互作用界面不同,这导致它们沿纤维长轴的扭曲程度不同,从而呈现不同的三维结构。
有趣的是,这个共同的β片层结构内核,与其他研究团队利用各种技术推断出的α-Synuclein单体亚基结构是高度重合的。这说明不同的α-Synuclein多态体可能都是通过不同排列顺序的相同基本模块聚合而成。这种通过亚基的重新排列组装来实现蛋白质多态性的机制,在淀粉样蛋白和tau蛋白等其他神经退行性疾病蛋白质中也有发现。
点突变导致多态体组装倾向转换
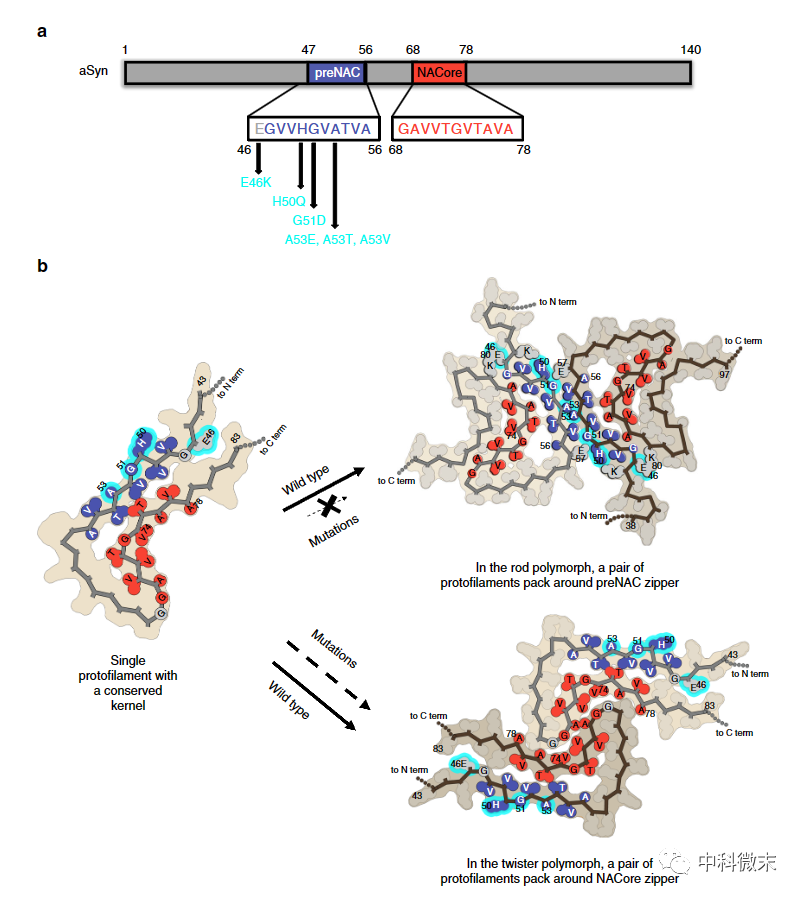
图2 α-Synuclein核心区域的突变影响多态体的正确组装
通过比较分析,科学家们发现这两种多态体亚基互动部位所对应α-Synuclein序列的氨基酸,正好坐落在该蛋白两大重要区域之上,即preNAC区域和NACore区域。从已有研究结果看,这两个区域包含的肽段序列已被证实是促成α-Synuclein聚合的重要因子。而且,preNAC区域还包含与遗传性帕金森病相关的6个点突变位点。
研究人员进行的计算机模拟分析发现,这几个点突变很可能会影响rod多态体亚基间的紧密结合互动,而对twister多态体结构的稳定性几乎没有影响。
换句话说,这些导致家族性帕金森病的致病突变,可能会通过扰乱rod多态体的正确组装,而倾向于形成twister多态体,从而改变体内α-Synuclein多态体原有的种群分布。考虑到不同多态体对神经元的毒性大小不同,这可能解释了不同基因背景下的帕金森病患者,为什么会表现出临床症状的差异。
结构多样性启示特效药物设计
本研究结果表明,异常聚合的α-Synuclein可以通过不同排列顺序形成结构迥异的多态体,这种多样性与其在疾病发生发展中的多样性生物学功能是分不开的。明确不同多态体级联反应的精确分子机制,将有助于在药物设计上进行有的放矢的研发。
例如,在设计帕金森病相关的α-Synuclein聚合抑制剂时,可以尝试优化针对不同多态体的亚基间界面位点的小分子化合物,这可能会成为治疗帕金森病以及其他α-Synuclein缠结类神经退行性疾病的全新策略。类似的思路,也正在淀粉样蛋白、tau蛋白等其他神经病变蛋白质相关药物研发中探索。
本研究中揭示的两种主要α-Synuclein多态体特征,为这些研发工作提供了针对性的结构基础。可以期待这些来自前沿结构生物学科研的进展成果,能为那些正在和帕金森病作斗争的患者们带来希望。
中科微末,作为深耕于结构生物学和AI领域的企业,已充分认识到提供优质结构解析服务的重要意义。中科微末依托自主研发的冷冻电镜技术,专注为生物医药企业提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。团队成员累积发表400+顶级SCI期刊论文,团队手握多项专利软著,在冷冻电镜技术工作流每个环节累积了大量独家算法和专利,可以提供“高难度结构有解决方案,低难度结构更迅速价格更便宜”的技术服务。展望未来,中科微末将继续致力于冷冻电子显微技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


