——背景——
NADPH氧化酶(NOXs)是目前已知的以产生活性氧物种(ROS)为唯一功能的代谢酶。在哺乳动物体内,NOXs存在7种旁系同源基因。这些基因彼此之间具有较高的序列相似度,且催化核心均由相似的两个结构域构成。具体来说,NOXs的N端为6条α-螺旋的跨膜区,其中四个严格保守的组氨酸与两个血红素分子结合,形成细胞膜内的电子通道;C端为胞内区,包含了NADPH和FAD的结合位点。然而不同NOXs的具体结构和催化产物不尽相同:NOX1/2/3/5催化产生超氧化物,后者在细胞内会自发地转化为过氧化氢(H2O2);NOX4和DUOX1-2则直接催化过氧化氢的产生。
NOXs所调控的ROS产生涉及到细胞内的氧化还原平衡。此外,NOXs还调控固有免疫、细胞增殖等现象。目前已经有研究发现,NOXs基因的高表达与多种癌症的发生相关。例如NOX1和NOX4的高表达涉及到结肠癌、乳腺癌、肺纤维化等疾病。NOX5在食管鳞状细胞癌、前列腺癌等癌症中高表达,而NOX2被认为与血液肿瘤高度相关。
基于NOXs对肿瘤的重要意义,NOXs被认为是一个潜在的ROS调控和抑癌靶标。NOXs的小分子抑制剂在调控ROS上具有多方面的优势。相比ROS清除剂,NOXs的抑制剂能够实现抑制特定的ROS来源而不干扰其他涉及到ROS的生物学过程。此外,设计靶向特定NOXs亚型的小分子抑制剂也有利于实现特性条件下的ROS调控。然而,人源NOXs高质量结构数据的缺失,以及能够将NOXs抑制与ROS清除两种机制较好地区分的测活方法的缺乏长期以来限制了这一领域的发展。来自意大利帕维亚大学的A. Mattevi和来自哈佛医学院/丹娜法伯癌症研究所的H. Arthanari于近期在Nature Chemical Biology上发表文章[1],报道了具有同工酶选择性的人源NOXs小分子抑制剂的高通量虚拟筛选,并基于筛选得到的化合物进行了骨架优化及活性测试。
——实验方法——
文章所报道的抑制剂筛选流程如图1所示。作者在早期工作中鉴定到来自一种微生物柱胞藻(C. stagnale)的NOX5,csNOX5,与人源NOX5具有40%的序列相似度,且两者的活性位点亦是高度保守的。因此,作者认为csNOX5的结构可以外推到人源NOX抑制剂的虚拟筛选。通过对csNOX5的结构分析,作者发现csNOX5的FAD和NADPH结合位点之间的裂隙是一个潜在的可药位点。因此作者使用开源的虚拟筛选平台VirtualFlow[2]分别针对csNOX5的脱氢酶结构域与FAD的共晶结构以及无FAD结合的晶体结构进行两轮虚拟筛选。每一轮中均筛选3.5亿个小分子化合物,其中3.4亿个来自Enamine的REAL数据库,其余的1000万个来自于ZINC15化合物库。对接结果按照对接打分进行排序,并过滤掉lopP过小或具有毒性官能团等的化合物。
对于虚拟筛选中挑选出的化合物,作者设计了多轮实验验证其生物学活性。首先在纯化的csNOX5上验证其抑制活性,对于10 μM下抑制率大于50%的化合物用热迁移实验进一步筛选,并挑选能使蛋白的Tm值升高2℃以上的化合物进行第二轮实验。第二轮实验中作者使用从NOXs高表达的细胞中提取出的膜系统组分进行人源NOXs的活性实验。此外,作者设计了多项对照试验以排除非预期功能的化合物,包括使用未转染NOXs细胞的膜系统以及未激活的NOXs进行对照试验以排除脱靶,采用PMS-NADH/NBT测试体系排除具有活性氧清除功能的化合物,在其他核黄素依赖的氧化酶上进行抑制实验以排除广谱抑制剂三项。对于从两轮实验中脱颖而出的苗头化合物,作者在体外使用纯化的人源NOXs进行了活性实验,并通过NMR或者晶体学方法验证其结合。进一步地,在细胞上测试化合物对细胞水平ROS的抑制情况,以及使用细胞热转移实验(CESTA)验证化合物在胞内的靶向性。
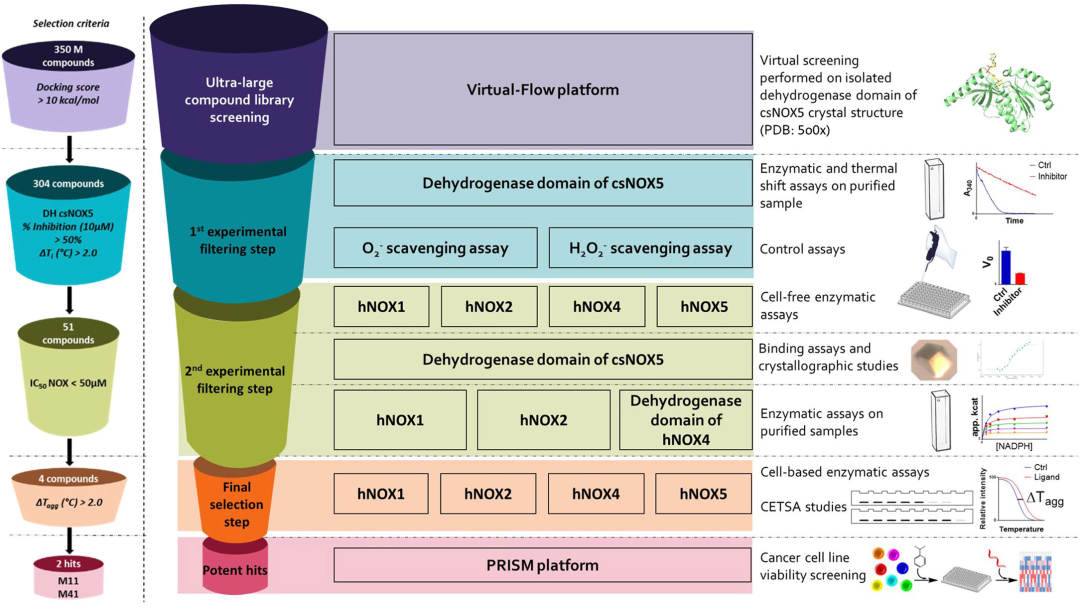
图1人NOX抑制剂筛选的实验流程
——主要结果——
两轮虚拟筛选以后,一共304个候选化合物进入第一轮实验,其中有51个化合物进入第二轮实验。最终,8个化合物通过了前两轮实验筛选进入后续的活性分析,罗列于图2。这8个化合物在csNOX5上都表现出了非竞争抑制的特点,抑制常数Ki在亚微摩尔到数十微摩尔不等。作者使用微量热涌动(MST)测定了化合物1和化合物3与csNOX5的亲和力,其解离常数Kd亦在微摩尔级别。
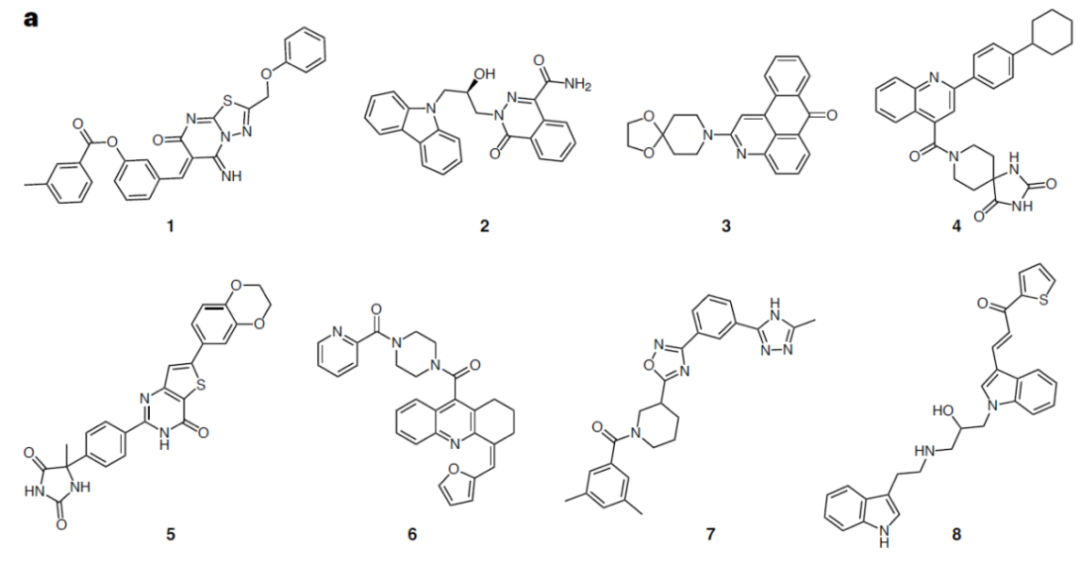
图2虚拟筛选和实验初筛以后挑选的8个化合物的结构
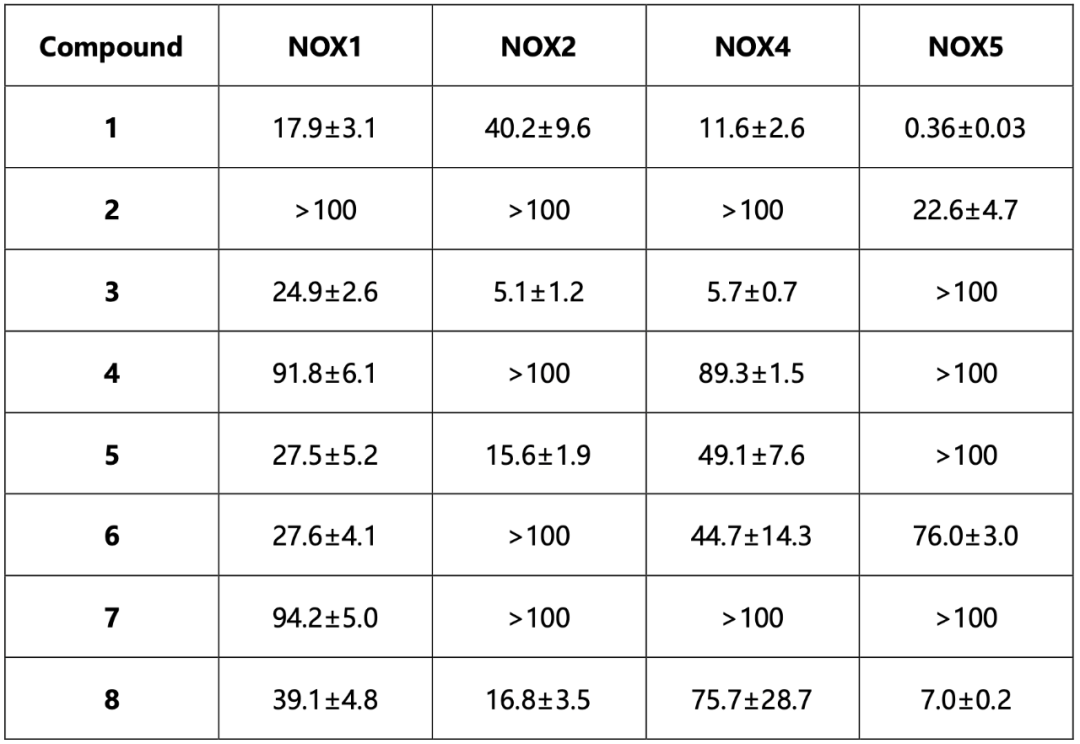
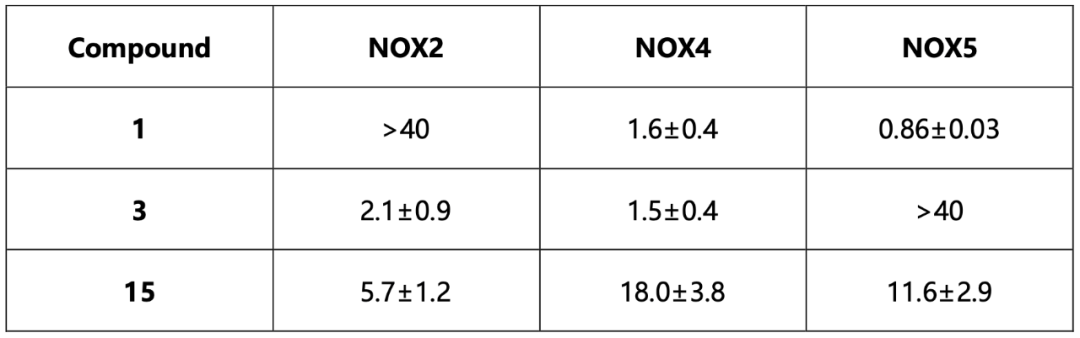
值得注意的是,所有8个化合物都是在FAD存在下的对接中被挑选出的,并且当FAD存在时,化合物对csNOX5的稳定化作用均变强,暗示FAD在化合物的结合和抑制机制中的重要角色。化合物与csNOX5的共晶结构解析进一步证实了这一猜想。图3列出了4个衍射较好的化合物与csNOX5的共晶结构,分别为化合物2(图3d),3(图3a),4(图3b),6(图3c)。所有化合物都正确地结合在了预期口袋内,并且化合物中的环系都与FAD产生了一定的堆积,这也解释了FAD在化合物结合中的贡献。此外,C668、T541等残基也参与到多个化合物的结合中。对于未能取得有较好衍射的晶体的化合物1,作者通过NMR滴定的方法确认了其与csNOX5的结合。进一步地,作者在含有人源NOX1/2/4/5的膜上对8个化合物进行酶活实验,以评估其IC50和Ki。通过比较化合物在不同NOXs亚型上的抑制效果,作者发现在8个化合物中,化合物3和化合物5可以作为人源NOX1/2/4的潜在选择性抑制剂,而化合物1可以作为人源NOX5的潜在选择性抑制剂(表1)。
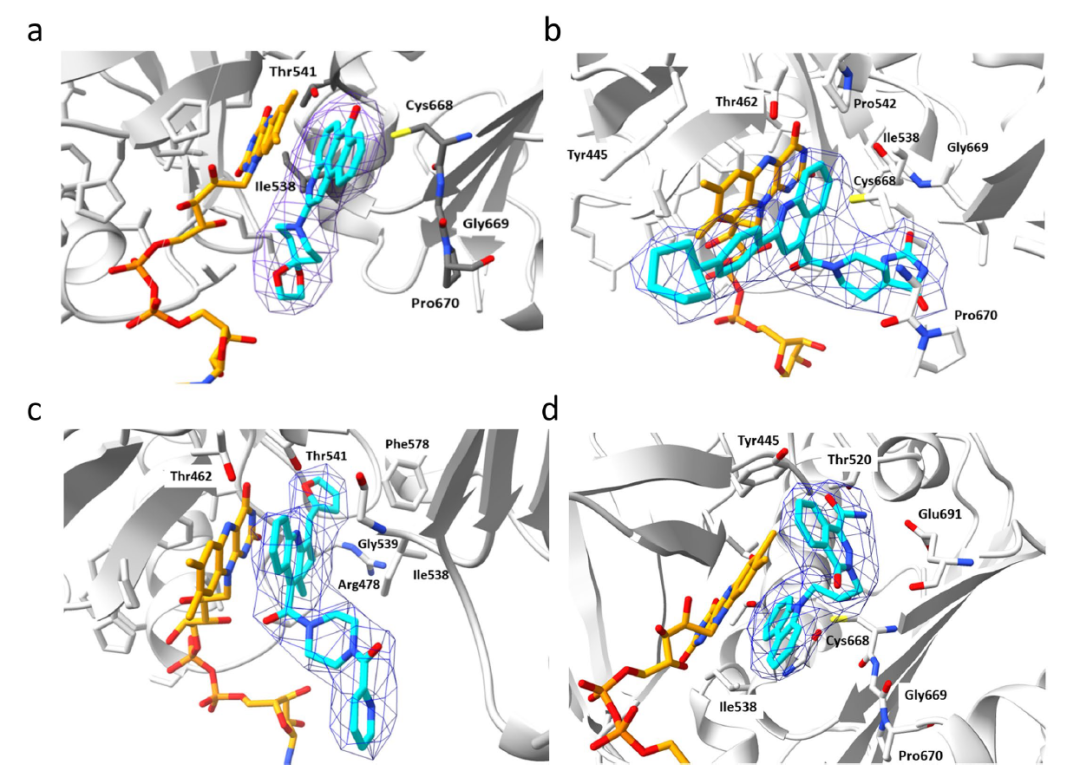
图3化合物与csNOX5的共晶结构分析
表1候选化合物对人源NOXs的IC50值(单位均为μM)
在分析候选化合物与csNOX5的共晶结构时,作者发现这些化合物都占据了原先csNOX5中C端一个与核黄素形成pi-pi堆积的苯丙氨酸的位置,暗示csNOX5的C端在结合抑制剂前后的构象发生了比较明显的改变,如图4。在先前的研究中,研究者们推测csNOX5的C端构象变化与蛋白和NADPH的结合能力密切相关,这一发现证实了这一推测,同时也指出苯丙氨酸偏移后的csNOX5构象可以用于抑制剂的虚拟筛选中。基于这一构象,作者在第三轮的虚拟筛选中筛选了1.54亿个化合物,并挑选出124个化合物进行了实验验证。
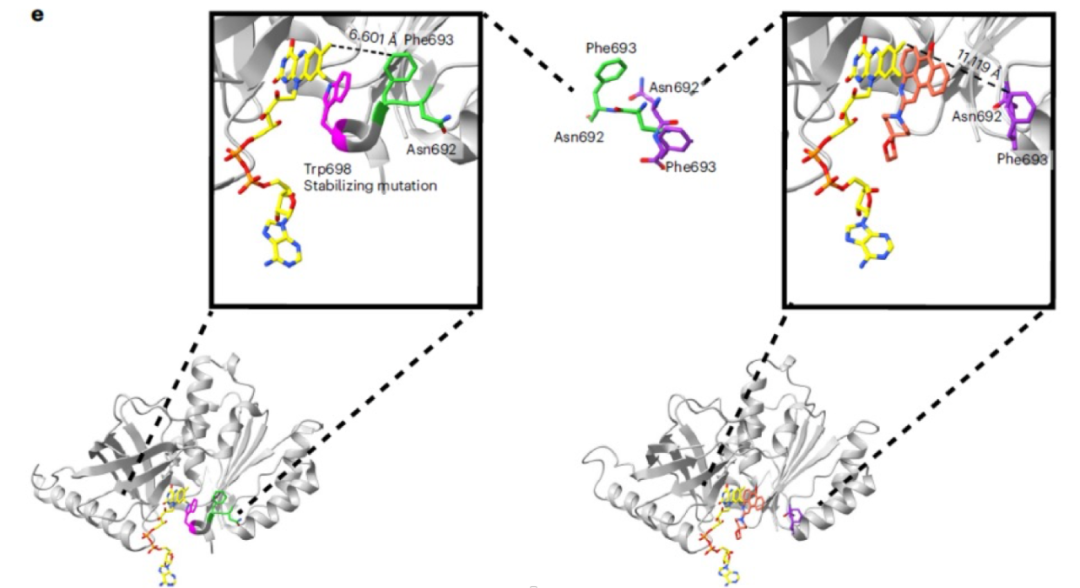
图4候选小分子抑制剂与csNOX5结合前后csNOX5 C端残基构象变化
经过与前述方法相同的多轮实验筛选后,作者挑选出了 4个化合物(如图5),并测试了其对人源NOXs上的抑制能力。遗憾的是,这四个化合物均未能在人源NOXs上表现出较好的活性。
图5针对csNOX5 C端变化构象对接筛选出的候选化合物结构
总结一下候选化合物的筛选阶段,作者提出了两种不同的虚拟筛选思路,并基于多种体外的活性实验一共筛选出了12个可能的活性化合物,其中3个化合物具有发展成人源NOXs选择性抑制剂的潜力。下面介绍作者针对候选化合物在酶活上表现最好的化合物3进行的简单骨架优化思路。化合物3可以分成四环的并环体系和[4,5]螺环两个部分,中间由一根sp2C-N键相连,在酶动力学实验上表现为非NADP竞争性抑制剂。作者先分析了csNOX5与化合物3和NADP+的共晶结构,以确认其抑制机制。当化合物3结合到csNOX5时,NADP+的烟酰胺与抑制剂和FAD形成三层的堆叠结构,因而NADP+和FAD之间的电子转移被抑制剂阻断(如图6b)。此外,化合物3中[4,5]螺环的结构在csNOX5结合NADP+前后也相对垂直于堆叠结构的轴发生了约120°的旋转,如图6a,作者推测这是为了避免螺环与NADP+产生大的碰撞。考虑到这种诱导适应性结合模式,作者推测提高螺环结构在分子中的转动灵活性对于提高化合物活性是有利的,因此引入了二级胺作为连接基团,得到化合物14.在化合物14的基础上作者针对[4,5]螺环部分的结构进行进一步的SAR,最终得到同时具有高抑制活性和良好NOX2选择性的化合物15。值得注意的是,从化合物14到化合物15,其选择性发生了明显的改变(化合物14对NOX2几乎没有抑制活性,而对NOX4/5活性较好)。
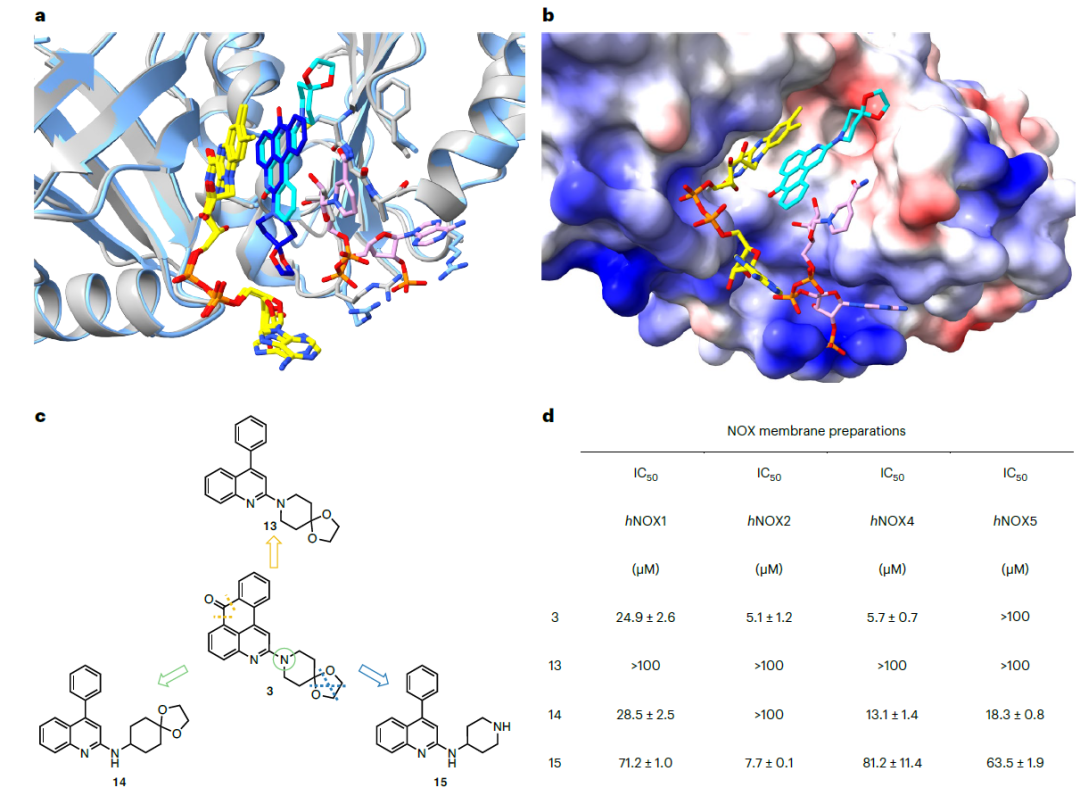
图6针对候选化合物3的结构优化
a. NADP+存在与否下化合物3与csNOX5的晶体结构对比,深蓝色为无NADP+的结构,浅蓝色为有NADP+的结构; b. 化合物3与csNOX5和NADP+的共晶结构; c. 化合物3的骨架改造; d. 骨架改造后化合物的活性结果
作者在细胞模型上进一步地测试了体外实验中拿到的候选化合物。在实验筛选时,作者已经通过对照试验排除了具有活性氧清除功能的化合物,因此可以直接通过使用相应激活剂刺激NOX2/4/5高表达的细胞株并检测ROS含量来评价化合物的细胞活。在体外活性较好的化合物1,3以及改造后的化合物15对不同亚型NOXs的细胞活性列于表2。CESTA实验验证了这些化合物在细胞内对相应NOXs的靶向性。对照体外生化实验和细胞实验结果,这些化合物对不同NOX亚型的选择性表现是较为一致的。
表2 化合物在NOXs高表达细胞模型上的EC50值(单位均为μM)
最后,作者使用了由Todd Golub等人开发的PRISM方法[3]系统地研究了候选化合物对癌细胞生长的抑制能力。PRISM方法的基本原理是使用慢病毒将24bp的条形码序列稳转到不同的肿瘤细胞系中,并将不同的肿瘤细胞系等量均匀混合后冻存。将制备好的混合细胞系复苏后加药处理,并提取处理后活细胞中的基因组DNA。基因组DNA的条形码序列被含有生物素的引物PCR扩增后,分别用含有相应互补序列的链霉亲和素微珠捕获,然后就可以对各种条形码序列进行定量,其相对数量差异就可以反映不同细胞系对化合物的敏感程度。PRISM实验指出多种血液瘤对化合物3最为敏感;相应地,这些肿瘤细胞中多存在NOX2高表达和激酶突变造成的ROS产生增加现象。这一结果也符合化合物3在体外和细胞实验中对NOX2的靶向性。此外,NOX4高表达的胶质母细胞瘤A1207,SNU1105和肾癌细胞系RCC10RGB亦对化合物3敏感;而对NOX5具有一定选择性的化合物1对NOX5高表达的泌尿系统肿瘤表现出较好的抑制能力,对其他肿瘤则无明显的抑制效果。这些结果说明开发选择性抑制不同亚型NOX的抑制剂的重要性和潜在价值。由于Ras激酶家族促进细胞增殖需要ROS信号,作者还在同时具有NOX2高表达和KRasG12D突变的肿瘤细胞系上测试了化合物3与KRas抑制剂MRTX1133连用的效果,并发现化合物3一定程度上提高了肿瘤细胞对MRTX1133的敏感程度。这些结果进一步地说明了开发ROXs抑制剂的潜在临床价值。
——小结——
作者从来源于微生物的NOX酶csNOX5的结构出发,通过高通量筛选和生化实验鉴定到了对人源NOXs具有抑制作用的小分子化合物。尽管这些化合物在结合模式上表现出了一定的相似性,都依赖于化合物与FAD形成的pi-pi堆积,其对不同亚型NOX的选择性有明显的差别。这一选择性进一步地被细胞实验和表达不同亚型NOXs细胞的PRISM实验所验证。除此以外,作者还在实验中发现了两个有趣的结论。一是通过比较csNOX5 C端在化合物结合前后的构象变化,验证了NOXs的C端构象具有调控NADP+结合能力和蛋白酶活的功能。遗憾的是,针对相应的非活性构象的虚拟筛选没有得到有潜力的化合物分子。二是将选择性NOXs抑制剂与KRasG12D抑制剂联用,提高了G12D抑制剂的抑制效果,暗示ROXs抑制剂在临床上的应用方向。由于人源NOXs的高分辨实验结构的缺乏(作者在文章中也提到了这一点),目前还不能讨论使用csNOX5进行虚拟筛选在多大程度上会影响结果。此外,从活性的角度来讨论,文章中对于化合物的SAR还尚不完善,对于为什么分子中螺环基团改变会影响选择性也没有机制层面的探讨。而SAR分析,尤其是对于不同同工酶的选择性进行构效关系探索,也需要高置信度的口袋结构。这也是文章研究主要的局限性之一。
参考文献
[1] Reis, J., Gorgulla, C., Massari, M., andet al. Targeting ROS production through inhibition of NADPH oxidases. Nat. Chem. Biol, 2023, 19, 1540-1550. doi: 10.1038/s41589-023-01457-5
[2] Gorgulla, C., Boeszoermenyi, A., Wang, Z., andet al. An open-source drug discovery platform enables ultra-large virtual screens. Nature 2020, 580, 663–668. doi:10.1038/s41586-020-2117-z
[3] Yu, C., Mannan, A. M., Yvone, G. M., and et al. High-throughput identification of genotype-specific cancer vulnerabilities in mixtures of barcoded tumor cell lines. Nat. Biotechnol. 2016, 34, 419-423. doi: 10.1038/nbt.3460
点击左下角的”阅读原文“即可查看原文章。
作者:钟书辰审稿:王丽莹编辑:黄志贤
GoDesignID:Molecular_Design_Lab( 扫描下方二维码可以订阅哦!)



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


