今天为大家介绍的是来自Christian Heinis团队的一篇综述论文。环状肽是一类在自然界中大量存在的迷人分子。多年来通过改进的合成方法和药物开发过程,新药稳定涌现,平均每年大约有一种环状肽药物获批。研究人员通过用于筛选随机肽库和从头生成配体的强大技术,已经实现了不依赖自然来源分子的环状肽药物的开发。

环状肽是由氨基酸组成的多肽链,它们在远距离位置连接形成大环状结构。在自然界中发现了形状、大小和化学成分多样的环状肽,展示了环状肽作为一类分子的巨大结构多样性。许多环状肽显示出显著的生物活性,范围从复杂生物过程的信号分子到防御用的化学武器,这表明了环状肽的功能能力。目前,有超过40种来自自然或其衍生物的环状肽被用作治疗剂。环状肽的卓越品质不仅限于临床应用,它们还是出色的研究工具,比如用于选择性调节目标蛋白的探针或用于生物分子成像的高亲和力配体。环状肽作为药物开发中的配体非常合适。与线性类似物相比,环状肽在多方面均有改善,如高结合亲和力和特异性、蛋白水解稳定性等等。绝大多数获批的环状肽药物靶向细胞外蛋白,通过注射给药。这种应用范围较窄与环状肽的膜透过性通常较低有关,特别是对于大型和极性的环状肽。然而,有几个例子表明,较小的环状肽能够靶向细胞内蛋白和/或可以口服给药,表明环状肽可以跨膜和/或口服。
自然界中迷人的环状肽
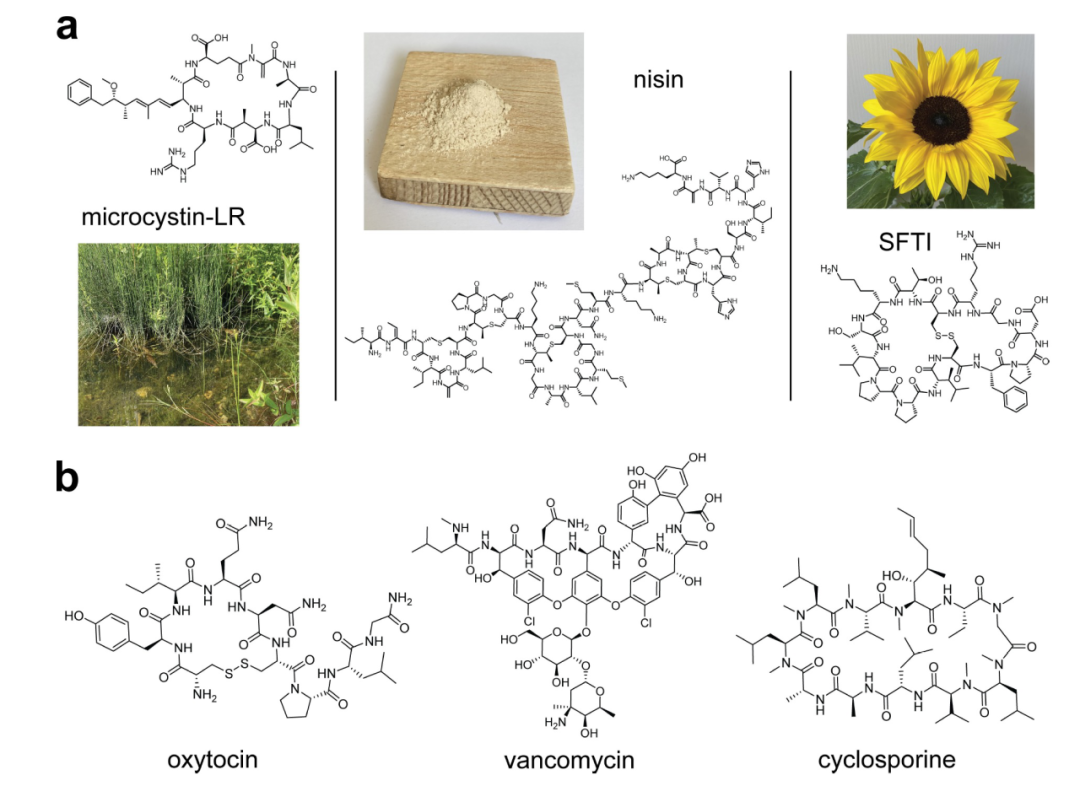
图 1
自然界利用环状肽来执行重要的宿主功能,如植物、真菌或细菌的防御,或动物的激素信号传递。实际上,无论好坏,环状肽在我们日常生活的许多方面都能找到,尽管它们可能并不总是被认识到。例如,淡水湖泊中由蓝藻花生产的微囊藻毒素就是一种天然发生的环状肽,对动物可能有害(图1a,左侧)。,五环肽奶酪素通常用作加工奶酪、肉制品、罐头食品和饮料中的添加剂,以延长保质期,因为它能抑制广泛的革兰氏阳性细菌的生长(图1a,中间)。
天然环状肽的结构可能非常复杂。许多包含非规范氨基酸或通过翻译后修饰或在非核糖体合成过程中引入的其他非氨基酸构建块,一眼可能不总是被认出是肽,如抗生素万古霉素(图1b,中间)。有些包含不止一个大环状环系统,形成偶尔会折叠成三维结构的多环分子。例如,向日葵胰蛋白酶抑制剂(SFTI)在向日葵种子中形成双环结构(图1a,右侧)。很多源自自然的环状肽或其衍生物被用作治疗药物,包括著名的药物如激素催产素(图1b,左侧)、抗生素万古霉素(图1b,中间)和免疫抑制剂环孢素(图1b,右侧)。这些以及其他一些环状肽药物位列世界卫生组织基本药物模型清单的479种药物中,显示了环状肽对医学的重要性。
环状肽激素类药物
多种人体激素基于环状肽,因此其合成版本可以用来调节各种身体过程和功能。例如,在身体不产生足够激素的医疗状况下,用受影响的激素进行补充可以恢复平衡并缓解相关症状。最初作为药物利用的环状肽激素是催产素和加压素,它们在1960年代被引入临床。这两种激素最初是由du Vigneaud在1950年代识别和合成的,都是具有由二硫键封闭的六个氨基酸环的九肽。它们的开发是环状肽的传统方式,即从动物组织中分离肽类,纯化,鉴定其活性,确定其一级结构,并生产出作为药物的相同分子。催产素主要用于在分娩期间引发或改善宫缩,或在分娩后减少出血(图1b,左侧)。加压素用于管理抗利尿激素缺乏或治疗尿崩症。催产素可能是应用最广泛的环状肽:仅在美国,据估计,每年超过300万分娩的女性中有一半接受催产素治疗。肽类的模块化结构使得容易产生天然肽激素的类似物,以创造具有改进活性、特异性、稳定性或其他感兴趣特性的化合物。例如,已经开发了多种加压素类药物,包括更稳定且广泛使用的合成类似物去氨加压素,在这种药物中N-末端的半胱氨酸被脱氨,并用非天然的对映体D-Arg取代易受蛋白酶降解的L-Arg残基。另一个为改进特性而修改的天然环状肽激素是生长抑素,这是一个14个氨基酸的肽,通过抑制其他激素的释放来调节多种身体功能。随后,缩短至8个氨基酸的环状肽,并通过突变改进稳定性和药理活性,产生了1988年获批的药物奥曲肽,自那以后该药物的年销售额超过十亿美元,因此达到了畅销药物的地位。两种类似的环状肽类似物,兰瑞肽和帕西瑞肽,在它们的药理活性上有所不同,分别于2007年和2012年引入市场。
环状肽用于治疗传染病
数百万年来,微生物进化出了大量具有抗菌活性的环状肽,作为化学武器帮助它们在自然环境中竞争。这些分子经过了演化的广泛测试,以验证它们在杀死或抑制细菌、真菌和其他微生物的生长以及对宿主的安全性方面的有效性。目前广泛使用的基于环状肽的抗生素包括万古霉素及其衍生物泰勒万古霉素、达巴万古霉素和奥利万古霉素。万古霉素用于治疗严重的革兰氏阳性细菌感染(图1b,中间)。万古霉素的衍生物是半合成产生的,由于药动学特性的变化和跨细菌菌株的活性不同,它们在药理效果上有所不同。2003年引入的一种新的针对革兰氏阳性细菌的抗生素是达托霉素,它是从链霉菌株中提取的环状脂肽,可以与细菌膜相互作用并破坏它。基于环状肽的抗真菌药物包括卡泊芬净、米卡芬净和阿尼德芬净,用于治疗酵母感染,如念珠菌属。这三种药物都属于棘白菌素类,并且是环状六脂肽。这些半合成药物是通过改造来自不同真菌种类的天然非核糖体环状肽而开发的,并分别在2001年、2005年和2006年获得批准。
环状肽的有利特性
鉴于环状肽众多的有利特性,包括卓越的结合性、良好的稳定性等,自然界使用环状肽作为执行重要生物学功能的配体并不令人惊讶。
环状肽可以比线性类似物更高亲和力地结合到靶点。也许对于环状肽更优越的结合能力最清晰的证据来自于噬菌体展示库的筛选,其中环状肽通常优于线性库成员。这可以在1990年Devlin等人提出的首批噬菌体展示选择中看到。在这里,针对链霉蛋白的线性肽段随机库筛选产生了许多在随机化氨基酸位置含有两个半胱氨酸的肽,这表明它们很可能以二硫键环化形式被分离]。在随后进行的许多体外选择实验中也做了类似的观察,包括针对广泛靶标的双环肽噬菌体展示选择,在噬菌体上不完全的化学环化产生了环状和线性肽的混合物,但绝大多数分离出的配体是双环肽。
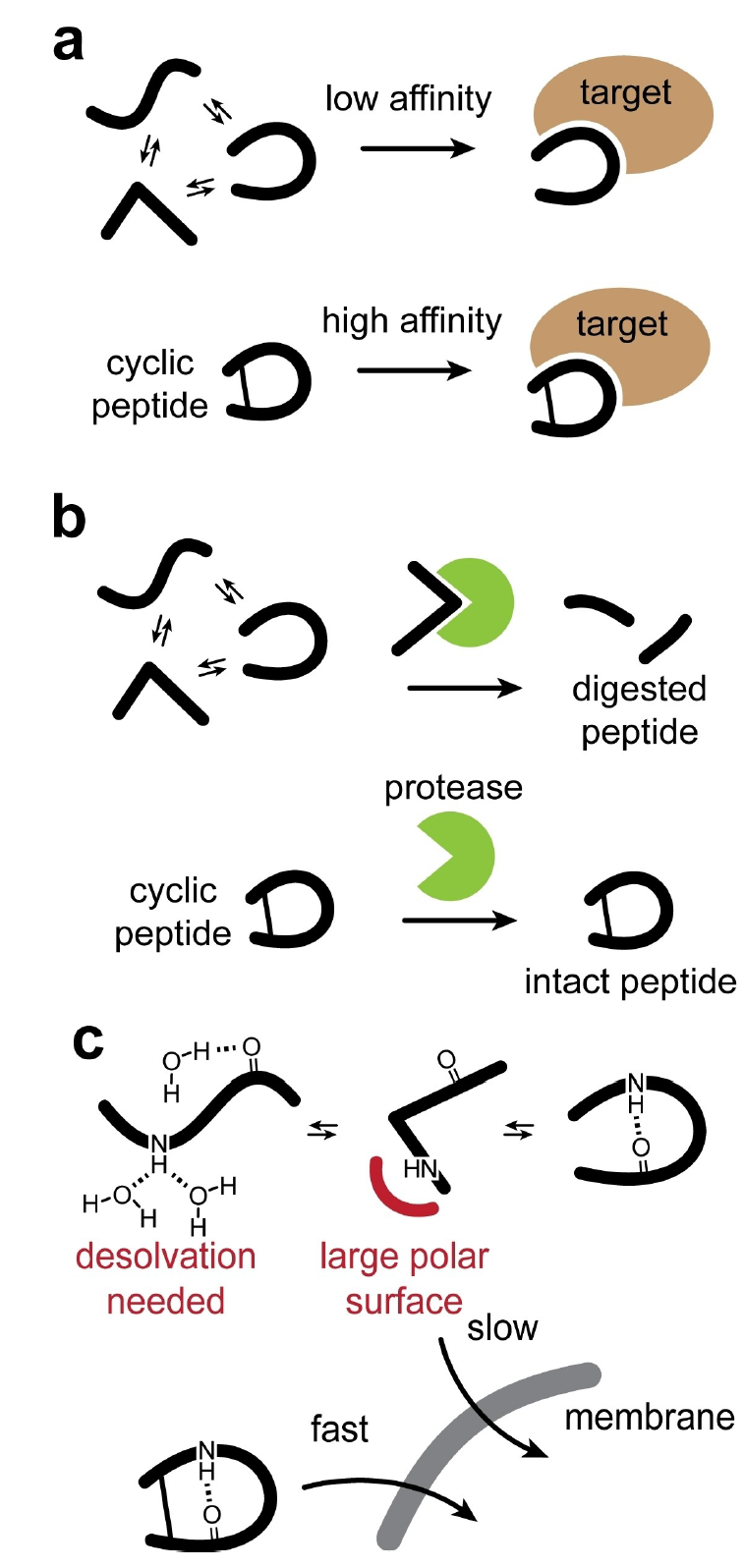
图 2
环化提高亲和力可能可以通过熵效应来解释。因为环状肽在溶液中比线性体更不灵活,所以结合到靶点时的熵惩罚更低(图2a)。线性肽可以采取更多的构象,而环状肽由于其环状结构的限制,能够采取的构象数量较少。在结合到靶点时,一个分子必须采取一定的构象,这称为“结合态”。由于环状肽能够采取的不同构象少,那么在任何给定时间里,更多的环状肽分子可能会处于或接近这个必需的结合态构象。因此,与线性肽相比,环状肽结合到靶标的可能性更大。这在作为折叠结构结合的肽中尤其明显,例如α-螺旋或β-链,在这些肽中,环化连接稳定了溶液中二级结构的较高比例。这一效果被战略性地利用来制造涉及α-螺旋的蛋白-蛋白相互作用(PPIs)的抑制剂。
环状肽的一个显著特性是它们相对于线性肽有更好的抗酶降解保护。肽主链的有限灵活性和应变通常阻碍了它们与蛋白酶的活性位点结合(图2b)。例如,主导肠道中肽降解的丝氨酸蛋白酶胰蛋白酶和胰凝乳蛋白酶或血液中的凝血蛋白酶要求它们的底物适应蛋白酶活性位点,以优化它们相对于催化位点的位置来稳定过渡态。基于它们对这些蛋白酶的抵抗性,环状肽采取这些构象可能更具挑战性,因此也更少见。此外,通过其末端氨基酸环化的肽被保护免受外切肽酶的降解,这种酶会从末端分解肽。
在穿越膜的疏水区域时,肽的极性基团如肽键的氢(H)键供体会被溶解,这对穿模行为构成了一个能量障碍。有趣的是,自然界也适应了这一点,因为环化可以促进肽内分子H键的形成,减少溶解,并同时隐藏一些极性表面,从而增加了膜透过性的可能性(图2c)。环孢素的分子内H键屏蔽效应已被观察并详细研究,环孢素是一个11氨基酸环状肽药物,尽管其体积较大,但它能够穿透细胞并可通过口服给药。为了有效穿越膜,环孢素在11个酰胺键中的7个上进行Nα甲基化,并且其余4个酰胺键H键供体形成分子内H键以隐藏供体和受体基团,以避开进入脂质双层时的疏水环境。对于靶点结合,环孢素改变其构象,并利用一些极性基团进行H键相互作用。当线性化时,环孢素的膜透过性降低,表明环状形状是形成分子内氢键所必需结构。环孢素的极性基团隐藏行为在其他天然环状肽中也被观察到,并且分子内H键已被战略性地利用来生成具有改善的膜透过性和口服可用性的其他环状肽。
肽合成
自艾米尔·费希尔于1901年合成首个肽以来,肽合成方法得到了稳步改进。主要的创新和发展包括固相肽合成(SPPS)、保护与去保护策略、高效的偶联试剂、自动化和微型化,以及高产率的环化策略。如今,完全自动化和免操作的方法能够从数百种商业上可获得的氨基酸构建块合成多样的序列和结构。这一能力在很大程度上归功于模块化和重复的聚合结构,以及胺基和羧酸官能团之间高效的偶联。尽管许多肽的合成,特别是短序列的合成通常比较直接,但在肽化学中仍然存在重大的合成挑战,例如合成较长的肽链、具有挑战性构建块的序列(例如N-甲基化氨基酸),或者合成含有肽键替代物的肽。
环状肽药物
在过去三十年中,平均每年大约有一种环状肽获批用于医疗用途,如今在这一分子类别中有超过40种可用药物(图4a)。在计算这些药物时,作者考虑了含有3到50个氨基酸且至少有两个肽键的环状肽和大环化合物。在这些新批准的药物中,有几种肽结构相似且具有相同的作用机制。作者将具有全新结构或作用机制的环状肽以红点标出(图4a),并在下方展示它们的结构(图4b)。在这些获批的药物中,有三种药物的环状肽与其靶标结合的结构最近通过X射线衍射或冷冻电镜解决,它们很好地展示了肽与靶标之间完美的形状互补性,这是其良好结合性质的基础(图4b)。
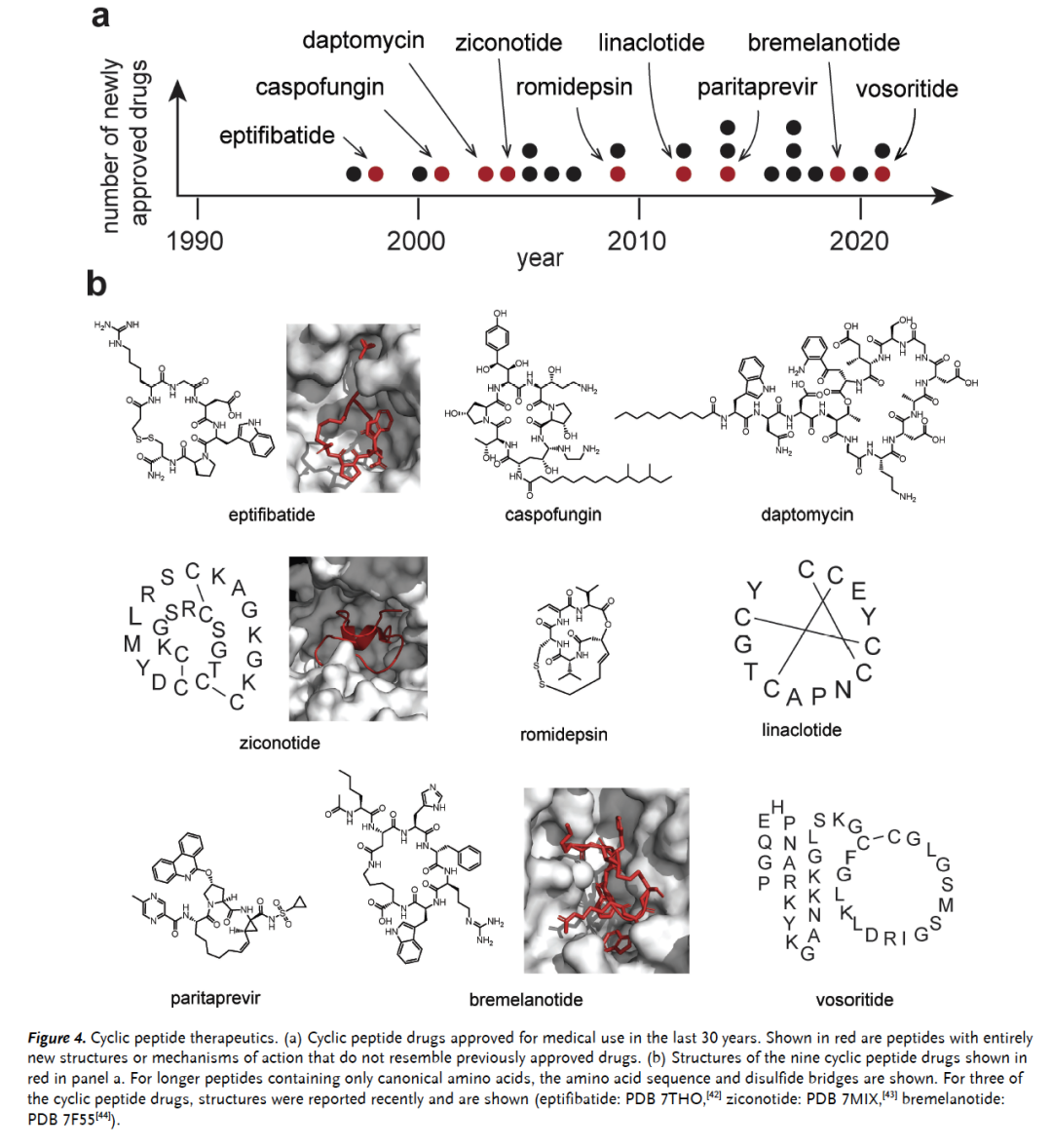
图 4
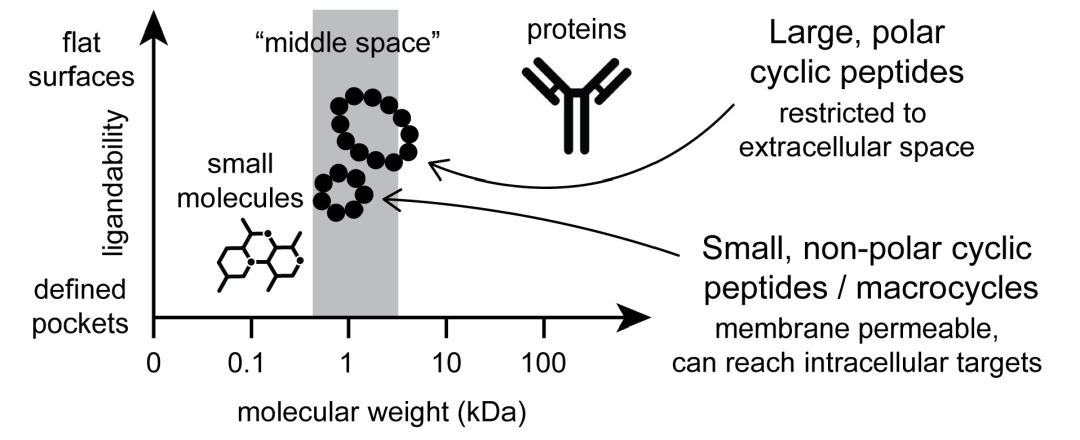
图 5
环状肽药物可以广泛分为膜透过性和非透过性两类,它们在应用范围上有很大的不同(图5)。膜透过性的环状肽通常体积较小(最常见的小于1千道尔顿),极性表面积有限,并且通常由许多非天然氨基酸组成。非透过性环状肽通常较大,包含超过10个氨基酸(>1千道尔顿),并且通常是极性的;这些被开发用于结合到细胞外靶标。大多数获批的环状肽药物属于第二组非膜透过性药物。虽然膜透过性环状肽药物目前仅由少数几种获批药物代表,但近期在理解和开发膜透过性环状肽方面的快速发展,为其在未来几年的强劲增长奠定了基础。
具有跨膜能力的小型环状肽因其能够针对目前被认为是“不可药用”的具有挑战性的细胞内靶点而越来越受到关注。这些靶点,包括蛋白-蛋白相互作用,通常具有相当平坦、缺乏特征的表面,缺乏定义明确的小分子结合口袋。环状肽可能为这些类型的相互作用提供一个针对许多这些靶点的解决方案,因为它们在这些相互作用中具有良好的结合属性。然而,要对细胞内靶点起作用,环状肽需要穿越质膜,由于它们的大小和极性表面,这并非易事。迄今为止,只有少数获得临床批准的环状肽针对细胞内靶点,包括免疫抑制剂环孢素、抗癌药物罗米德普辛,以及治疗丙型肝炎病毒(HCV)的药物帕提普雷韦、格拉普雷韦、沃西拉普雷韦和格利卡普雷韦。后四种HCV蛋白酶抑制剂通常被分类为肽类似物或大环药物,因为它们都只含有三种氨基酸以及几种非氨基酸构建块。环状肽可以通过多种路径和机制进入细胞,尽管被动扩散是到目前为止最有效的。为了跨越膜的非极性区域,肽必须具有有限的极性表面积。与此同时,它们不能太疏水,以确保在扩散和靶标结合所需的水环境中的溶解性。为了降低极性表面积以开发膜透过性环状肽药物,通常会省略带有带电和极性侧链的氨基酸,并且限制肽键的数量。为了生成仍然足够大以形成足够接触点以结合到具有挑战性的靶点的肽,一个常见的策略是使用N-甲基化或N-烷基化氨基酸来消除酰胺键的氢键供体效应。另一种策略是基于工程化的”变色龙”环状肽,它们可以适应不同的形状和表面,既适合良好的水溶性和靶标结合,也适合膜渗透。
一系列生物活性环状肽被发现可以通过口服给药,证明了这些分子通过口服途径应用的可行性。与基于注射的策略相比,口服给药提供了明显的优势,如患者的便利性、更灵活的剂量调整,以及由于肠道较慢释放,导致的更长暴露时间和较低峰值浓度。然而,口服给药的药物必须克服许多障碍,如抵抗胃和肠道中的高蛋白酶压力,穿越上皮屏障进入血流等。目前,只有少数环状肽药物可以通过口服给药。这些包括尽管其大尺寸(1203道尔顿)也能被动跨膜的环孢素,刚刚描述的膜透过性HCV蛋白酶抑制剂,以及人类激素药物去氨加压素。后者的口服生物利用度不到1%,对于药物来说这是异常低的(与等效剂量静脉注射相比的血浆水平),但由于环状肽的高效力,它仍然实现了治疗效果。有多种策略可用于提高肽的口服可用性,它们中的大多数通过减小尺寸和极性表面以及提高稳定性来实现。增强肽类药物口服可用性的额外策略基于制剂,并涉及诸如肠溶药片涂层、蛋白酶抑制剂或渗透增强剂等方法。
环肽配体生成
凭借其化学和结构多样性的构建模块以及几乎无限的三维结构可能性,环状肽为与一些最具挑战性的靶标相互作用提供了可能,包括蛋白质-肽相互作用。然而,由于自然界并未演化出针对每一个理想靶标的配体,现在由我们来应用从自然界学到的原则,生成针对新蛋白质的环状肽配体。幸运的是,自然界为我们提供了大量的环状肽供我们学习,以设计我们自己的肽。设计策略利用了已知的肽配体丰富的现有序列、结构和功能数据,而这些数据每天都在增长。通过考虑现有的结合物数据以及设计理念,合理设计策略通常只需要合成少量肽即可发现结合物。
作为这一发现过程的起点,大多数设计方法使用天然蛋白质或肽的短肽基序,这些基序能与感兴趣的靶标结合。线性序列在溶液中灵活,并倾向于具有低结合亲和力,因此它们被环化以强制它们进入类似蛋白质的生物活性构象。设计过程中的一个关键步骤是找到适当的环化位置和连接器,它们能将所需的构象强加到肽基序上。由此产生的环状肽可以表现出类蛋白的生物活性和效力,使其可以作为生物探针和治疗、诊断和疫苗的引导。作为一个额外的策略,肽的靶标结合区域已被嫁接到具有明确结构的较大肽框架上,如环肽。这样的折叠更好地将明确定义的构象强加到结合基序上,以提供良好的结合亲和力,这些系统被证明能产生高度抵抗蛋白酶的肽。
环肽设计策略最近从创新的计算方法如从头设计和计算机筛选中获得了启发。如用于计算建模和蛋白质分析的Rosetta软件等强大工具,已成功应用于设计环状肽配体。例如,基于弱的D-Cys-L-Pro二肽配体,创建了效力提高50倍的金属β-内酰胺酶抑制剂。此外,通过采样各种环状肽构象还从小分子锌螯合剂设计了组蛋白去乙酰化酶抑制剂。然而,当前的设计方法依赖于作为起点的结合基序,还不能从头提出基序。尽管结合性质的设计仍然具有挑战性,但如上所述,已在计算设计可透过膜的肽方面取得了重大进展。
参考资料
Ji, X., Nielsen, A. L., & Heinis, C. (2023). Cyclic Peptides for Drug Development. Angewandte Chemie International Edition, e202308251.





 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง



