
点击蓝字 关注我们

微末生物
Nanomega BioAI
引言
生命体之间有多种相互作用的方式,而对于细菌这样的单细胞生物来说,与自己“身边”海量的细胞和病毒进行生命活动的交互显得尤为重要。然而,这种交互常常以一种“不友好”的方式进行——噬菌体侵染细菌,细菌通过免疫途径降解外来核酸,噬菌体反过来再限制细菌的免疫,还有细菌通过分泌毒素对周围细胞进行杀伤。正是在这个过程中,产生了包括限制性内切酶、CRISPR等对生物医学研究带来极大影响的“分子机器”。
今天我们想向您介绍一种独特的、通过噬菌体样的方式对周围细胞实现“远程膜穿孔打击”的细菌毒素,它是细菌和噬菌体中常见的属于收缩-弹射系统的一种分子机器。您将会看到,来自美国加州大学洛杉矶分校(UCLA)的周正洪教授团队是如何通过冷冻电镜初步解析了这一纳米机器的三维结构,并由此出发回答了其运作机制相关的“谜题”。这篇重要的论文Atomic structures of a bactericidal contractile nanotube in its pre- and postcontraction states发表在Nature Structural & Molecular Biology上。
正文
在糖尿病患者血糖监测、门诊采血化验等场合下,除了一般意义上的静脉取血,还经常会使用在指尖取血的方法。传统的指尖采血时所使的是一种针头外置的一次性采血针,但针头外置的设计不仅可能引发患者的心理不适,还存在着意外划伤、扎伤导致交叉感染的安全隐患。因此,在1991年,美国BD公司(Becton, Dickinson and Company)发明了一种“触发的”指尖采血器(图1)——安全锁卡式采血器。
你或许也见过这种采血器。它的针头并不显露在外,而是被锁卡暂时固定在保护套内部。只有当外壳端部受到指尖的挤压时,针头才会从保护套中弹出,刺穿皮肤;而一旦采血完成,弹出的针头将会被重新收回锁定而无法二次使用。这能够最大程度的保护患者和医护人员免遭病毒感染等意外伤害。
然而,这样一种发明于20世纪末,并在现代医疗环境中得到广泛使用的采血器件,竟然还有一个在自然界中的“缩小版”:细菌和噬菌体的“收缩弹射系统”(Contractile ejection systems,CES,图1)(注释①)。在这一主要由蛋白质构成的系统中,可收缩的外鞘(Sheath)利用基板复合物(Baseplate)形成着力点,以尾丝和目标蛋白的结合作为触发因素,通过收缩旋转动作折叠外鞘,将携带效应因子的刚性内筒(Tube)穿刺进入受体细胞。在细菌与噬菌体乃至真核细胞之间展开的这场疯狂而激烈的“军备竞赛”中,强大的选择压力早已于上亿年前将这套分子机器雕琢清楚。在接下来的漫长岁月中,历经无数的修饰、改造和分化,收缩-弹射系统已经成为了如今广泛分布于众多原核生物和噬菌体阵营中的“绝对利器”。

图1 左:一种安全锁卡式采血器;
右:收缩弹射系统的模式图(图片来源于网络)
在这些收缩-弹射系统中,有:
-
以T4噬菌体为代表的肌尾噬菌体科(Myovirus bacteriophages),从自己的尾鞘内部弹出内层管道,刺穿大肠杆菌的细胞壁和细胞膜,将噬菌体基因组及其附属蛋白注射到菌体内部进行侵染;
-
以霍乱弧菌(Vibrio Cholerae)为代表的各种臭名昭著的病原体,通过使用自己细胞膜-壁上装备的细菌VI型分泌系统(T6SS)将毒性蛋白打入目标细胞,不仅能加强自己在同类之中的竞争力,还能够对真核细胞造成杀伤;
-
另一类是细胞外收缩注射系统(extracellular CIS,eCIS)。不同于IV型分泌系统,eCIS虽然也承担着注射内部效应分子(蛋白质或核酸等)的任务,但它在组装完成后一般会被分泌到胞外(或者通过细胞裂解释放),以受体细胞膜为锚定点进行细胞攻击。最近发现eCIS也可以攻击真核(小鼠)细胞。
值得注意的是,这最后一种eCIS中,还存在着几种截然不同的类型。其中一种保留了传统的“注射”功能,也就是将分子机器内部运载的蛋白和核酸等一举打入目标细菌体内来对其进行攻击,比如发光杆菌属中的PVC蛋白(注释②);而另一种则截然不同,其中没有搭载任何内含物,仅依靠在靶向的细胞壁-膜上打孔,就可以破坏离子浓度平衡,对目标造成高效的杀伤。这种既不通过蛋白,也不递送核酸,仅仅通过打孔来破坏目标细胞的“导弹”般的收缩弹射系统,就是我们今天的主角——绿脓杆菌的R型脓杆菌素(R-type pyocins,图2)。
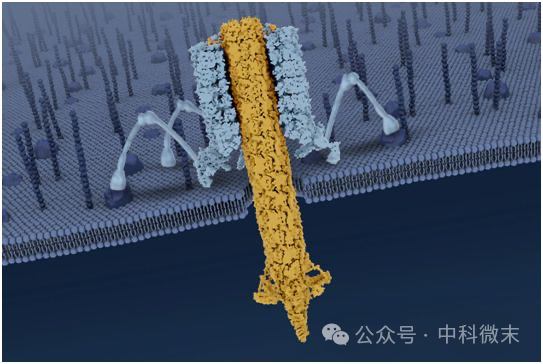
图2 R型脓杆菌素穿透细胞膜 概念图
(图片来自Zhou Lab/UCLA)
R型脓杆菌素(R-type pyocin)是绿脓杆菌(Pseudomonas aeruginosa, 也称为铜绿假单胞菌,G-)所释放的一种蛋白复合物,可以用来破坏与它相竞争的细菌。绿脓杆菌本身经常导致临床上的感染疾病,而对于这种细菌本身,人们已经进行了广泛而深入的研究。
在此之前,大量关于收缩-弹射系统的研究都集中在了T4噬菌体的尾鞘上。在这些初步研究中,人们已经大致确定了驱动收缩的能量实际上来源于组装时的外层“鞘”中留存的自由能。也就是说,收缩后的“鞘”要比收缩之前的更加稳定,而从热力学上讲,“鞘”的部分通过收缩从高能状态变为低能状态,所释放的能量就可以用来突破细胞膜。但是,这种能量如何在分子原子尺度上得以储存?外层鞘为何能够收缩自如?在收缩和穿透细胞膜的时候外鞘结构如何不因受力而散架?还有,为何外形看似一致的不同系统可以递送包括离子、核酸和蛋白在内如此之多截然不同的物质?由于尚未获得内层的“内筒”和外层的“外鞘”的原子结构模型,这些都成为了未解之谜。
周正洪教授团队决心对这一“分子导弹”的内筒及外鞘结构进行解析。通过冷冻电镜(Cryo-EM)三维重构技术,研究人员很快获得了关于内筒和外鞘在收缩前后分别为3.5Å和3.9Å的超高分辨率结构。
R型脓毒素的整体结构可以分为三个主要部分(图3):底板(baseplate),内筒(tube)和外鞘(sheath)。在底板部分,冷冻电镜的解析结果中可见6条尾部纤维(tail fibers)的初始部分和底板中间的突刺(spike)。尽管这一部分的结构并不清晰(这不是他们的主要目标),研究人员还是确定了在突刺末端的中心部分存在嵌入的金属离子——这对细胞膜的突破过程来说很可能是关键的。
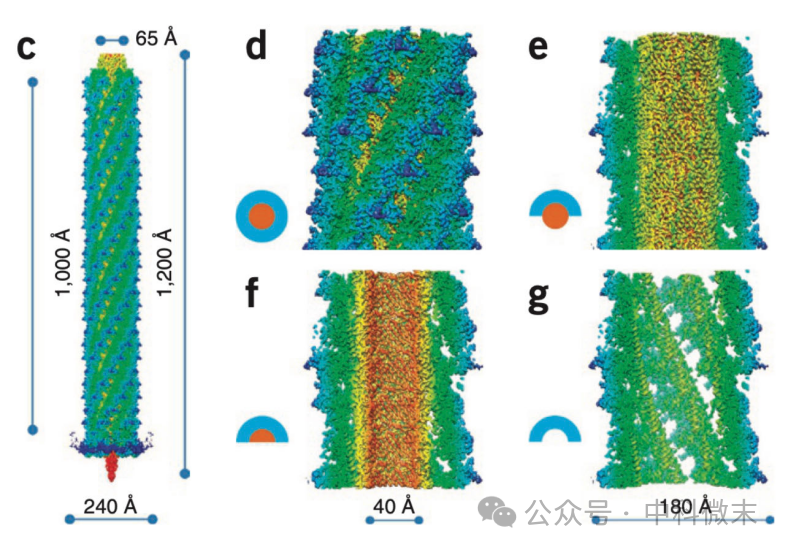
图3 R型脓毒素的整体结构
右侧表示各剖面结构。c中可见右手螺旋的排列方式,在d中外鞘部分隆起的脊(蓝色)和下陷的沟十分明显。
分子机器的主干部分则由内筒和外鞘构成。和多种已知结构的收缩-弹射系统一样,R型脓菌素的主干蛋白也有着轴向的“六重旋转对称”的组织形式——也就是说,如果把组成主干的每一平层(disc)都分开来看,可以发现其内外各由6个亚基围成一圈。这样的层片交错堆叠起来(错开一定角度),就在内筒和外鞘都形成了整体形态为右手螺旋的壁面。
内层亚基组成的柱状体壁面相对来说比较平滑,而外鞘则起伏较大,每一个外鞘蛋白向外突出的幅度更多,顺着螺旋的排布,形成了较为明显的“脊”和“沟”(图3)。内层亚基本身延续了在收缩-弹射系统蛋白中较为典型的三级结构,由90°交叉的双层β折叠片合拢成为近似于桶状的外形,并且在彼此之间以互补的电荷相互作用黏合在一起。有趣的是,当研究人员将R型脓杆菌素内筒的『内表面』,也就是和递送物相接触的表面,与T6SS、各种噬菌体的相应部分比较时,他们发现R型脓毒素内筒的内表面与其他同类分子机器并不相同,是以负电荷为主——尽管它们在序列上的差异很小,但T6SS的内表面几乎布满了中性残基(不能进行主动运输),而噬菌体则布满了正电荷(用来运载负电的DNA)。这体现了结构和功能的相互适应。
位于外层的“外鞘”亚基的结构则揭示了更为重要的谜题。结构解析显示,在收缩之前外鞘的蛋白与蛋白之间形成了一种看似“反直觉”的结构——与内层截然相反,它们彼此之间几乎没有直接贴合的静电相互作用。考虑到外鞘在触发前需要储存足够的能量,而触发后要发生大幅度收缩,收缩后的结构又过于紧密和稳定,静息状态下的外鞘蛋白确实需要在不发生紧密接触的情况下组合成一个相对稳定的整体。可这又要怎样才能做到呢?
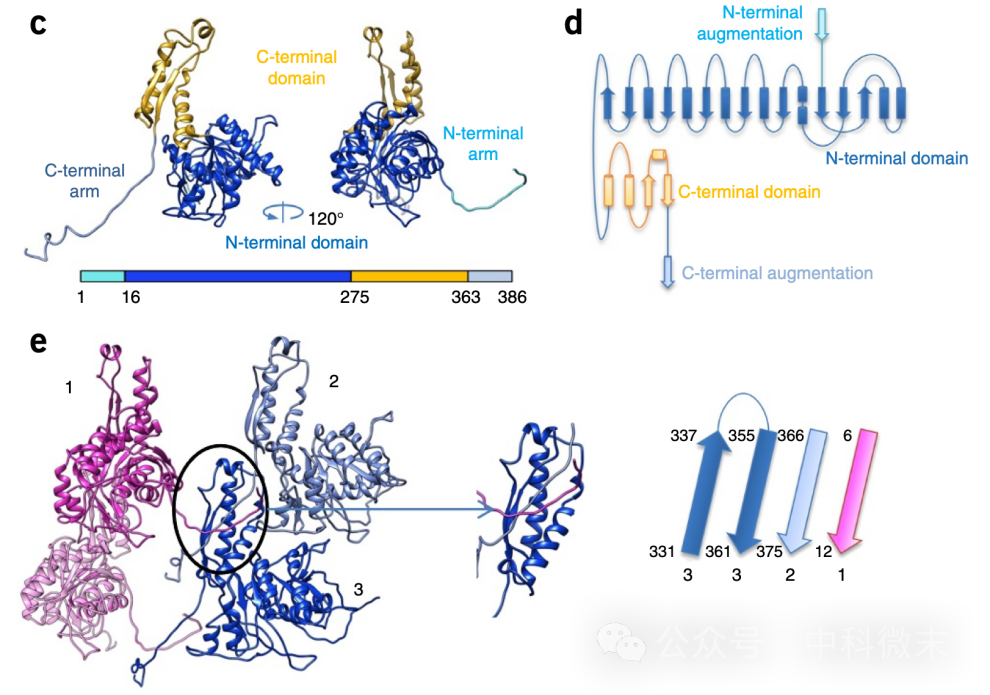
图4 R型脓毒素的外鞘蛋白及其相互作用
e图中1-3显示了三个外鞘蛋白的相互作用,其中1和2位于同一层片上,而3位于1-2所处的平面下。123三个蛋白单体都不形成紧密的相互接触,但3的C端同时结合着来自1和2的两条伸长片段。
研究人员很快发现,外鞘的蛋白亚基除了两个主要的球状结构域(图4,上半部分,蓝色和黄色)外,在N端和C端还各有一个较长的延伸片段。千万不要小瞧这两条看似纤弱的延伸片段——他们如同『铰链』一般,分别向下方、向右下方探入下面一层的两个并列的蛋白亚基的【C端结构域】(图4,下半部分)。这也就是说,对于一个外鞘蛋白亚基来说,它那由β片层和α螺旋所搭建起来的C端结构域不仅由其自身序列组成,还容纳着两个外来的片段(图4e,浅蓝色和粉色,作为两个β折叠片插入其中)。外鞘蛋白亚基之间这种将【自身】与【外来】β折叠片之间相互黏合的方式不仅利用了片层之间的氢键作为维持结构的力量,还通过疏水相互作用对这一连接方式进行了进一步加强。
以一连二,将众多节点通过铰链相互交织成一张巨网——这就是将大量外鞘蛋白在不发生紧密互作的情况下成功组织到一起的“诀窍”所在。
不难看出,这样构成的平面网络结构可谓是根深蒂固。并且,由于铰链部分具有一定柔性,它们避免了在收缩过程中外鞘因为蛋白之间的滑动而分崩离析。事实证明,在收缩前后,尽管外鞘在直径上发生了明显的扩张(从18nm到24nm,图5),尽管外鞘的几何外表变化巨大,但外鞘的结构本身,从蛋白单体到复合物的网络连系方式,都成功维持在了原状。这是一种无比精妙的,通过操控『柔性铰链——线』和『不动刚体——点』来实现较大尺度上的蛋白质协同运动的组织思路。
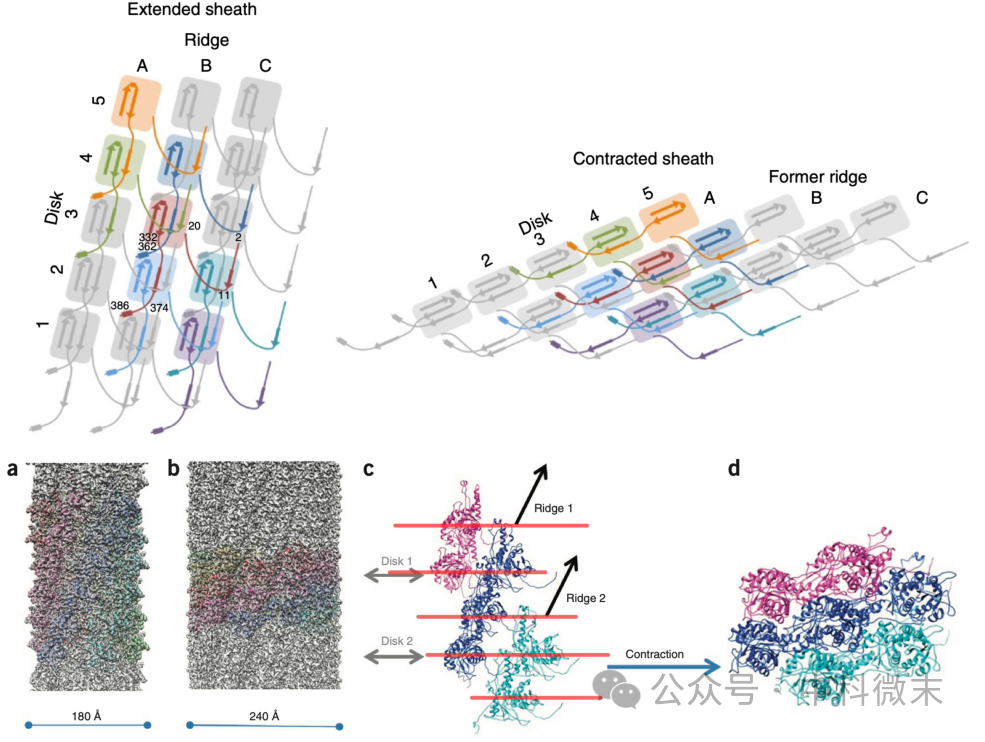
图5 外鞘在收缩前后的冷冻电镜结构对比
上方的示意图显示了R型脓毒素中亚基与亚基之间连接成网络的独特方式。下方图c中的红线表示层片,而这些层片的间距在d中被紧密的压缩在了一起。
结合冷冻电镜所解析的的高分辨率结构,我们现在可以来总结分析一下R型脓毒素这一分子机器完成其生物学过程的原理及其细节:
-
【搭建-assembly】首先,分子机器需要以一种高能量的状态被搭建起来;
为了提供前后的能量差,外鞘蛋白彼此之间事实上能够形成非常强大的相互作用(图6,左)。如果让外鞘蛋白在复合物搭建的开始或过程中就发生紧密接触,那么提前形成的结构将会是相当稳定的,这样的结构甚至能够抵抗化学方法的解离。这就好比一枚导弹在制作过程中就因为受到了撞击而发生引爆——对工厂来说,能量在一个错误的地点释放,会引发严重的事故;对细菌来说,则是能量的浪费和原材料的浪费。
为了避免这一过程,细菌会在底盘上率先组装好毒素的内筒部分。结构数据显示,内筒和外鞘蛋白亚基之间相接触的平面上有一块三角形的“电荷互补片”(图6,右)。它可以让二者实现较弱的相互作用,因此内筒可以作为脚手架,一定程度上指导外鞘的装配。
外鞘蛋白将从底盘开始,从头进行组装。底盘会首先确定最下方的第一层外鞘层片的位置,而接下来的聚合过程就都在内筒的帮助下依序进行。在这样的安排下,外鞘蛋白就如同底盘作为“引物”而“内筒”作为模板来发生建构,成功地保证了外鞘蛋白彼此之间不会紧密接触,但仍可通过作为铰链的延伸片段互相联系。这种通过拉开蛋白距离而储存自由能的方式就像是制造了一个可以随时触发的“分子电池”。
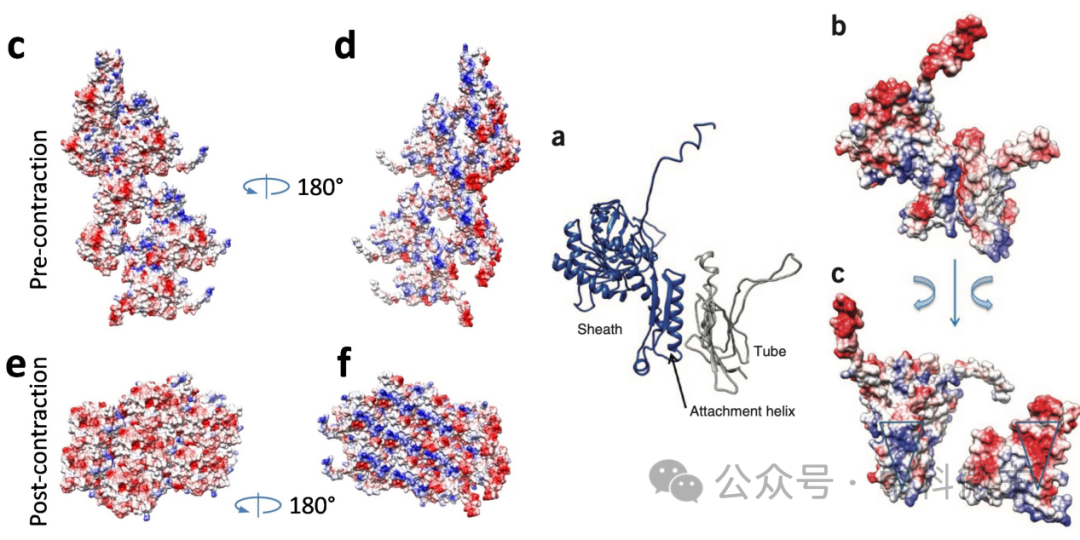
图6 静电相互作用示意图
左:外鞘蛋白之间。收缩后的外鞘蛋白之间形成了大量新的静电互作位点。这些位点并非集中成片,而是以一种更加复杂的形势散落分布。
右:外鞘蛋白和内筒蛋白之间。装配后的外鞘和内筒单体间存在较弱的一对一的静电互作,这种互作集中为右图c中框出的一对三角形区域。
-
【触发-activate】然后,这枚“分子导弹”被分泌到细胞外。蛋白还需要一个触发过程,在其击中目标时给其以启动收缩并释放能量的信号;
-
【收缩-contraction】收到信号后,外鞘开始收缩,推动内筒突破细胞壁和细胞膜。
因为外鞘蛋白之间能够形成相当强大的互作,整个外鞘的收缩会以极高的速度进行。在这种瀑布般的级联效应下,-12kcal/mol的能量一举释放,推动内筒尖端的金属离子突破细胞壁和细胞膜;由于外鞘蛋白由独特的网络结构组织起来,在收缩过程中,层与层之间的距离就会被迅速压缩变小,外鞘蛋白也将会相对于原始位置发生进一步的滑移。这样,蛋白亚基之间相互靠近压缩,并以稳定的形式结合起来。最终,这发尖锐的“导弹”命中目标,目标因离子梯度遭到破坏而分崩离析,而“导弹”本身也完成了它的使命,变为了一个稳定但无法再发挥功能的“沉寂”的复合体。
至此,周正洪教授团队通过使用冷冻电镜解析R型脓毒素的外鞘和内筒结构,在原子尺度上分析了其能量储存和外鞘收缩过程的原理。然而,在当时,研究人员并未获得该复合体底盘部分的高分辨率结构,也就暂留了“从尾丝传导上来的触发因素将以何种方式决定和启动外鞘的收缩”这一谜题未解。但他们并未就此打住——
2020年,周正洪教授团队再度就这一主题于Nature发表文章Action of a minimal contractile bactericidal nanomachine,通过解析出复合体【底盘】部分更加清楚的三维结构,他们彻底解开了这一“生物导弹”中全部的“结构密码”,为这种“分子机器”在医学方面的实际应用奠定了重要的基础。在那篇文章里,冷冻电镜又将会为我们带来什么样的惊喜呢?欲知事后如何,请关注中科微末,听下回分解!
目前,包括R型脓毒素在内的“收缩-弹射系统”作为一种拥有悠久演化历史的生物大分子机器,已经开始在新型抗病原体药物开发、基因编辑和疫苗递送系统建立、创新型癌症治疗药物研发等方面展现出强大的应用潜力。中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
注释:
①还有一种说法是contractile injection system(CIS),即“收缩注射系统”。二者在概念上所包含的范围有少许不同,并不是所有的contractile system都有注射功能,而本文所介绍的R–type毒素就是一类不具备注射功能的收缩穿刺系统。本文所参考的原文献作者充分考虑到了这一点,因而在原文的introduction部分就使用了“ejection”一词。本文尊重原文献作者的意见。
②PVC蛋白来自发光杆菌(Photorhabdus)属的一种线虫共生菌P. asymbiotica,研究人员将它的eCIS命名为Photorhabdus virulence cassette(PVC)。值得注意的是,北京大学高宁团队2019年3月在Cell上发表了P. asymbiotica的PVC的高分辨率冷冻电镜结构,而在2023年3月,CRISPR大牛张锋团队就取材于同样的发光杆菌的PVC,通过alphafold预测目标蛋白结合结构域局部的方法,开发了能够靶向真核生物的全新的蛋白质递送系统,这一成果发表在Nature上。这是结构生物学与蛋白质结构解析指导和助推生命系统改造成为工程与应用“神器”的又一次典型例证。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流




 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง





