
点击蓝字 关注我们

微末生物
Nanomega BioAI
2023年12月23日,美国福克斯新闻网报道称,美国黄石国家公园首次检测出“僵尸鹿”病毒,引发各界关注。患病的鹿变得如同僵尸一般,会流口水,极度消瘦,不怕人,还极具侵略性。该病于20世纪60年代首次在北美野鹿群体中被观察到,且感染范围仍在不断扩散,而这也引发了科学家们对于该病是否会传染给人类的担忧。值得注意的是,感染它们的病原体并非是一般的“病毒”,而是一种没有任何核酸或者“基因组”成分的传染性蛋白质颗粒——朊病毒。
什么是“朊病毒”呢?它有着怎样的历史?又有着什么样的分子结构?周正洪教授团队等人合作在Nature Structural & Molecular Biology上发表文章Cryo-EM structure of a human prion fibril with a hydrophobic, protease-resistant core,使用冷冻电镜(Cryo-EM)揭示了一种能够体外合成的、同时抵抗变性和蛋白酶的人朊病毒rPrPRes原纤维在原子级分辨率下的三维结构和由于空间结构不相容性引起的可能的致病机制,为治疗这一“世纪顽疾”提供了新的机会。
一、“丧尸”样的疾病和元凶朊病毒
蛋白质是生命的物质基础,是生命活动的主要承担者。而蛋白质行使其功能要依赖特定的空间结构,一旦蛋白质的空间构象异常,便会引发特定疾病,对个体甚至特定种群造成灾难。朊病毒疾病就是由于蛋白质构象异常导致的疾病中最著名的一种。前文提到的“僵尸鹿病”是由在鹿科动物中传播的一种高度传染性朊病毒引起的,在北美许多种圈养和野生的鹿科动物中都曾发现过。
这并不是这种病第一次受到关注。早在1985年,在英国东南部的阿福德镇,朊病毒引起了著名的“疯牛病”:一头头奶牛突然倒地抽搐,口吐白沫,经历数天痛苦挣扎后凄惨死去。
更可怕的是,人们后来发现,这种朊病毒可以转染给人类,使人类呈现丧尸一样的症状,且死亡率达到100%。在上世纪50年代,在南太平洋的岛国巴布新几内亚发生的“库鲁病”,让人类初步窥见此类病毒在人类身上发作的模样。据说当时,当地原始部落中,患病人浑身颤抖、发烧、丧失语言功能、无法控制自己的身体,最后在无休止地跳舞中死去。人们发现,感染性的朊病毒疾病患者几乎都食用过疑似带有朊病毒的病肉。显然,某种诡异的病原体从疯牛疯鹿等动物的身上通过肉传给了人。
这种蛋白质类病原体在1982年被确定为“朊病毒”——虽然叫病毒,但却不是病毒。与正常病毒不同,它本身是一种“丧尸化的蛋白质”,拥有非常强大的繁衍和变异功能。之所以要把它称为“病毒”,因为它和病毒一样都是一种非生命体。朊病毒疾病是由朊病毒蛋白(PrP)在体内发生错误折叠所导致的传染性海绵状脑病,是一种慢性并可在多种哺乳动物之间传播的致死性神经退行性疾病,根据感染来源可分为散发性、家族遗传性和感染性三种类型。
尽管化学组成是蛋白质,朊病毒却对传统的物理和化学消毒具有惊人的抵抗力:耐高温(加热至360℃仍然有致病性)、无法被蛋白酶消化分解、不呈现免疫效应、不诱发干扰素产生、不受干扰作用等。
现在,我们已经知道了朊病毒的病理特征主要为细胞中具有正常构象的细胞型朊蛋白(PrPC发生错误折叠形成病理型的朊蛋白(PrPSc),不同的病理型可以形成多种不同的朊病毒株型,引发不同临床症状,导致不同疾病。为了探究错误折叠的奥秘、进一步明确从PrPC到PrPSc转化的机制,需要构建适宜的朊病毒蛋白的原纤维结构作为研究对象,再加上体内的转化很难进行实时监测,因此,体外合成朊蛋白纤维对于朊病毒研究极为重要。在这项周正洪教授团队等人合作的研究中,他们在体外重组了一种朊蛋白原纤维。由于只有当蛋白质空间结构相似时,其功能才相似,因此为了验证重组的蛋白具有和体内的蛋白相似的功能,从而保证重组蛋白能够用来探究朊病毒的物理化学性质,用冷冻电镜对该重组结构进行观察也尤为重要。
二、冷冻电镜观察和验证构建的rPrPRes结构
这篇研究用冷冻电镜观察了一种重组朊蛋白原纤维的结构,这种朊蛋白原纤维是由人类朊病毒蛋白残基94-178组成的,名为rPrP 94-178,以下均简称为rPrPRes。rPrPRes包含蛋白酶抗性核心和疏水区域的大部分,因此也具有疏水性和蛋白酶抗性的特征。同时,它是一个和疾病相关的片段,可以让我们深入了解朊病毒组装体的生物物理特性。
构建的过程主要是将已知的蛋白残基混合重组纯化。研究人员发现其中产生了多种异质聚集体,包括一个主要的形态,即为未分枝原纤维(宽约8-10nm,螺旋节距约126 nm)和几个不太丰富的形态,如无定形体、棒状或带状的聚集体等(厚度从7.2-18.8nm不等),如图1显示。主要形态原纤维约占选定颗粒的71%,其余各形态共约占所选颗粒的29%。
为了验证重组的原纤维的结构,研究人员利用冷冻电镜,通过三维密度切片技术记录了原纤维有序区域的尺寸和周围的漫射密度,如图1(右)所示,并将从冷冻电镜得来的数据,包括键长、键角、螺旋等进行收集、细化、统计和比较。结果显示rPrPRes与朊病毒的六肽拉链结构一致。基于结构和功能的统一,一致的结构方便了团队根据朊病毒的六肽拉链结构模拟出了原纤维中适合紧密淀粉样蛋白包装的构象。
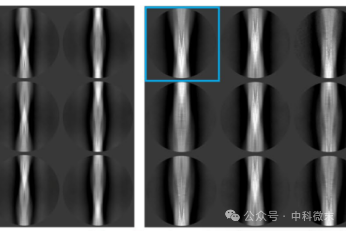
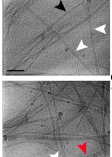
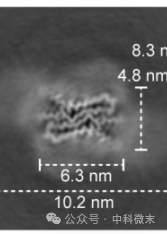
图1 从左到右以此为原纤维形态(左)、其他几个不太丰富的形态(红、白、黑箭头所指位置,中间图片)、三维密度切片(右)
三、冷冻电镜下探索rPrPRes结构性质
验证了rPrPRes与体内转化的朊蛋白的性质具有相似性之后,研究团队接着对rPrPRes的进行一系列研究。
首先是rPrPRes原纤维的稳定性。通过着色和基于溶剂化能计算的每个残留物的稳定能,研究发现rPrPRes原纤维是一种致密的低能量结构。与致病的原纤维一样,rPrPRes的结构表明,具有蛋白酶抗性的人类朊蛋白原纤维在特定的环境下,如患病者体内,可表现出典型的淀粉样蛋白特征。
接着是rPrPRes上的关键残基变异的不相容性与疾病发生的关系。家族遗传性的朊病毒疾病的发生与朊蛋白基因的突变密切相关。已发现引起家族遗传性朊病毒疾病的PrP突变位点共33个,包含42种不同氨基酸的突变。研究团队发现rPrPRes与蛋白质病理学的相关性受rPrPRes与序列变异的明显不相容性影响,这些变异可能改变致病的PrPSc的结构和朊病毒疾病的过程。
利用rPrPRes研究关键残基序列变异的相容性问题的空间模型如图2所示。右侧红框区域包含残基G127和M129的转向区域的放大图。其中,左侧两个侧视图显示由于沿着纤维轴有空间冲突(下方的红色所示),V127之间并不能兼容,而上方的G127未产生空间冲突;右侧纤维轴图显示模型可以容纳M129和V129的多态性(即,改变此位置的氨基酸并不会产生不兼容的情况),但V129在rPrPRes的转弯区域引入了一个小空隙(如图中黑箭头所示)。下方蓝框区域显示了两个与格斯特曼综合征(一种朊蛋白病)相关的突变体A117V和G114V均产生了空间冲突(红色所示),两者在rPrPRes中都很难被容纳。
将以上对结构相容性的分析反映到个体患病上,可以得出:由于在rPrPRes的原丝界面上产生结构冲突,家族突变体(A117V)和自然突变体(G114V)与朊蛋白相关疾病密切相关,而由于突变体G127V的相容性,G127V可抵抗疾病的发生,这也解释了为什么G127V突变体小鼠朊病毒原纤维需要更高的单体浓度和更长时间才能出现疾病状的生长、成核。
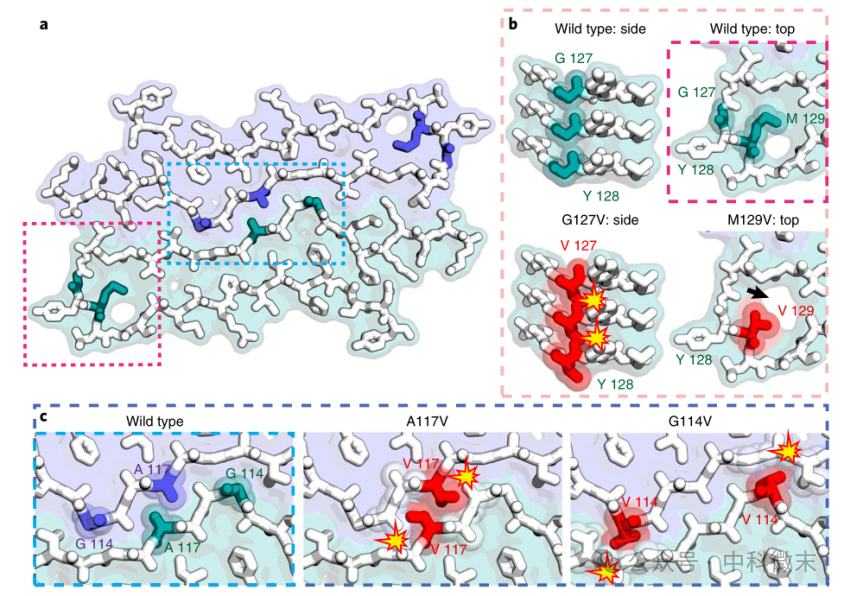
图2 在rPrPRes中关键残基上的序列变异的相容性
总体而言,rPrPRes的结构和与疾病相关的朊病毒的核心残基、片段大小、尺寸、蛋白酶抗性和变性抗性一致。PrP (G127V)的自然序列变体可以完全预防朊病毒疾病,并有望诱导减小rPrPRes结构中蛋白层之间的冲突,降低rPrPRes相互的不相容,从而达到治疗的目的。
四、构建rPrPRes的意义
朊蛋白突变可能使其形成具有淀粉样蛋白特征的原纤维。由于体外生成的朊病毒在某些条件下可以更好地控制原纤维多态性分布,研究团队在体外重组了朊病毒组装体rPrPRes原纤维,用冷冻电镜观察其结构,验证了rPrPRes的低能量、紧密几何结构以及rPrPRes的蛋白酶抗性区域和纤维尺寸与从患者体内分离的朊病毒相似,为评估和比较与蛋白酶抗性的朊病毒体外组装相关的特性提供了一个框架。
利用rPrPRes研究空间不相容性,以此对疾病的形成进行了初步解释,这也为评估朊病毒序列变异对其整体折叠和对朊病毒疾病的潜在影响提供了帮助。
同时,rPrPRes与从朊病毒株中分离的原纤维仍然存在明显的结构差异,如不同来源的朊病毒上有rPrPRes无法重述的某些结构的重复序列。而这也体现出从原子尺度比较rPrPRes和尚未确定的其他朊病毒多态性结构的必要性,揭示重组和组织分离的朊病毒组合的原子结构可能为朊病毒不同菌株的特定特征提供研究线索。
五、结构生物学技术解析生命奥秘
与朊病毒的发现一样,朊病毒原纤维(包括rPrPRes)结构的揭示,为解开基于蛋白质的“致命感染”之谜提供了新的机会,同时也为该病毒的临床研究、诊断以及药物研发提供了新的思路。从大分子物质到小分子甚至是近原子结构的观察,冷冻电镜作为结构生物学技术中蓬勃发展的一员,为揭示生命现象背后的奥秘做出了不可磨灭的贡献。有了它们,蛋白质结构的解析变得不再遥不可及,我们期待着朊病毒毒株结构的一步步揭示将为朊病毒的原子定义提供蓝图。
中科微末作为国内结构生物学与人工智能技术的探索者,已充分认识到提供优质结构解析服务对于生命科学研究的重要意义。依托自主研发的冷冻电镜技术,我们专注于提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。中科微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,中科微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


