
点击蓝字 关注我们

微末生物
Nanomega BioAI
“颠一颠”、“拍一拍”、“激光碎大石”,作为最常见的泌尿系统疾病之一,肾结石具有较高的患病率和复发率,使不少人“肾”心交病。因为以钙为主要成分的肾结石最为常见,在肾中大量表达的重要钙离子转运体TRPV5将成为预防和治疗肾结石的潜在新靶点。
来自加州大学洛杉矶分校(UCLA)的周正洪教授团队等人合作在Nature Structural & Molecular Biology上发表文章Structural basis of TRPV5 channel inhibition by econazole revealed by cryo-EM,用冷冻电镜观察益康唑抑制下的TRPV5通道的结构;通过比较TRPV5和其他TRPV通道的结构,并结合分子动力学对结合益康唑下的TRPV5通道进行模拟,首次解析了小分子抑制TRPV5通道的机制,对TRPV亚族成员的探索又迈出了重要一步。
一、审“石”度势的“钙”世之才
肾结石是最常见的泌尿系统疾病之一,病因是尿液中的矿物质过饱和,形成结晶并在肾盂和肾盏内沉积。肾结石的患病率高,人类一生的患病风险为10%-15%,平均10个人中就有1个人会经历肾结石病的困扰。此外,肾结石的复发率也高,5年复发率约为50%。肾结石会导致肾绞痛、血尿、梗阻积水、肾功能损害,且可能合并感染,严重时甚至会危及生命。
肾结石中80%是含钙结石,高钙尿症是肾结石发生最重要的致病因素,在35%-50%的肾结石患者中均有发现。尿钙的最终浓度取决于肾的远曲小管,并通过集合管上的钙通道TRPV5的跨细胞转运重吸收。
可见,通过增加细胞表面肾钙通道TRPV5数量,可增加钙离子运至细胞内的数量,进而可降低肾石病的风险。此外,还有研究表明,TRPV5与骨关节炎的发病有强烈的相关性。
这个重要的“钙离子的搬运工”叫TRPV5,全称为:The transient receptor potential vanilloid 5,即辣椒素受体瞬时受体电位香草酸亚家族成员5,对钙离子具有高度选择性,在钙离子的重吸收中起关键作用。它有5个兄弟姐妹,分别为TRPV1、TRPV2、TRPV3、TRPV4和TRPV6,2021年诺贝尔生理学或医学奖便授予了TRPV1的发现者美国科学家David Julius,TRPV1的发现揭示了温度感知的机制,丰富了人们对温度感知和适应周围环境的认识。它们6个蛋白质兄弟姐妹们同属于TRPV亚家族,即被天然存在的辣椒碱——辣椒素所激活,辣椒素英文Vanilloid,因此也取其首字母用于名字中。这个离子通道亚家族也有5个兄弟姐妹,分别是:TRPC、TRPM、TRPP、TRPA、TRPML,同属于瞬时感受器电位通道(transient receptor potential,TRP)的家族成员,TRP通道是一类可调控阳离子跨膜流动的非选择性阳离子通道,广泛分布在外周及中枢神经系统。
为方便理解,将TRPV5所属的家族“族谱”简单示意如下:
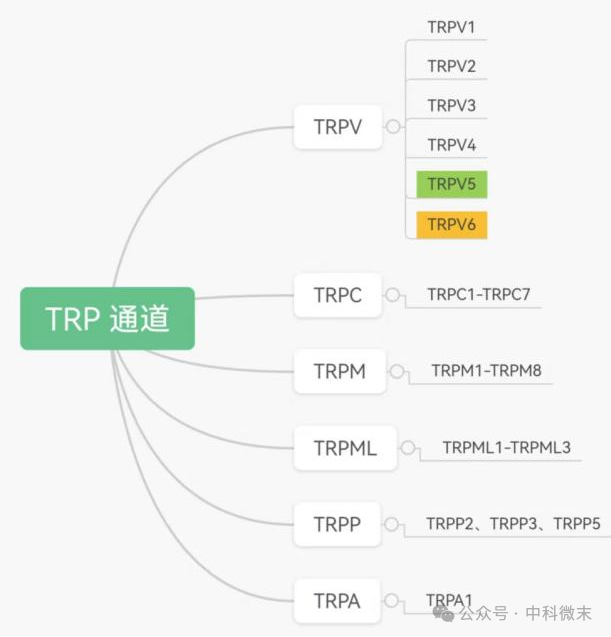
图1 TRP家族
已经有文章证明益康唑(Econazole)和咪康唑(Miconazole)可有效抑制TRPV5和TRPV6①,这也意味着长期使用一些含有益康唑或咪康唑的药物时可能增加肾结石的风险。两者均属于常用抗真菌药物,其中本文主要研究的益康唑,对皮肤癣菌、霉菌和酵母菌(如念珠菌)等有抗菌活性,对某些革兰氏阳性菌也有效。
团队利用兔的全长TRPV5,用冷冻电镜揭示益康唑结合到特定疏水口袋中,这种疏水口袋与TRPV1中磷脂酰亚苷和香兰素类占据的位置类似;结合后的TRPV5结构采用封闭的构象,具有明显的下门,阻断钙离子通过通道的渗透,提示TRPV通道中配体识别和脂质结合的保守机制。
正如直到冷冻电镜领域发生革命性进步,科学家才第一次测定并获得TRPV1和TRPV2的原子结构、才有TRPV亚家族成员的原子结构一样,冷冻电镜在本研究中也发挥了不可磨灭的作用,通过它观察了结合益康唑的TRPV5的全长、聚合体、离子孔结构,为最终分析抑制的机制奠定了基础。
二、一步步解锁“钙”世装备
1. 冷冻电镜确定结合益康唑的TRPV5的结构
实验材料选用兔的TRPV5,因其与人的序列同源性较高(>80%),孔道区域(pore region)的相似度更高。
图2展示了4.8埃分辨率下结合益康唑的TRPV5的冷冻电镜密度图(调整了密度图的阈值,展示三个视图),跨膜区域的局部分辨率在3.5到4埃之间,用RELION2.0进行3D类重建。TRPV5是四聚物离子通道,每个单体用不同的颜色(橙、蓝、粉、青色)表示,小分子益康唑用黄色表示。
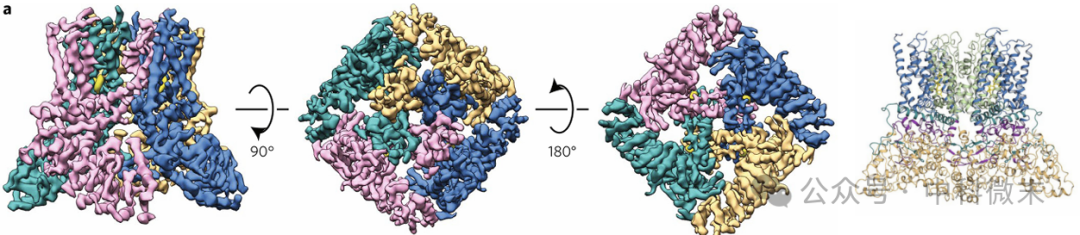
图2 结合益康唑的TRPV5的四聚体结构
2. 整体TRPV5通道的架构
TRPV5中存在的结构域示意图如图3(左)所示,虚线部分表明结构尚不明确,包括跨膜的螺旋状物S1-S6,氨基N末端的锚蛋白重复序列(ankyrin-repeat domain, ARD),连接结构域(linker domain)和碳基C末端的TRP结构域。全长的TRPV5和其他TRPV亚家族的结构相似。图3(中)为结合益康唑的TRPV5的单体模型,从不同结构域及其结构细节中可看出其折叠方式。
分析单体时观察到有两个非蛋白质的密度区,这两个密度区相邻于通道的跨膜区域,其中之一在S4和S5的每个亚基和S6的相邻亚基之间,结合益康唑,如图3(右)所示。在研究此结构时,发现TRPV5的抑制剂益康唑结合TRPV5的位置和TRPV1的抑制剂辣椒素类似物结合TRPV1的位置相似,推断TRPV通道的脂质结合口袋是保守的。
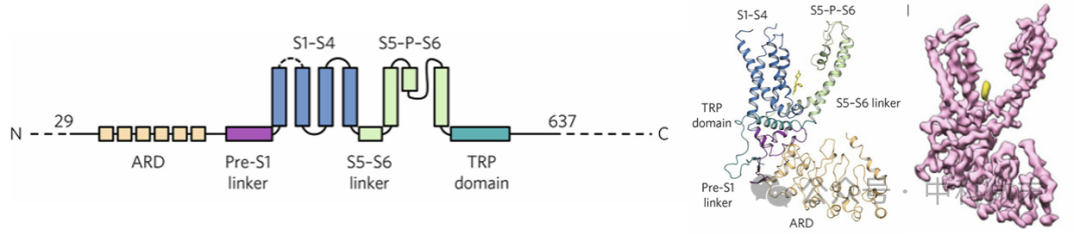
图3 TRPV5中的结构域的示意图(左),显示结构域的结合益康唑的TRPV5单体模型(中),结合益康唑的TRPV5单体的密度图(右)
3. 疏水口袋与关键残基:益康唑结合的口袋
观察到益康唑密度周围的几个残基在TRPV5和益康唑之间的作用范围内,其可能参与了TRPV5与益康唑的结合。在分子动力学模拟中,一些残基与四种益康唑分子中至少三个作用在4.0埃以内,则这样的残基被指定为假定的益康唑结合袋,包括图4(左)中标注出的6种氨基酸;且模拟的数据支持假设:这些主要的疏水口袋可识别和结合小分子,如抑制TRPV5和TRPV6的益康唑和咪康唑。
为了进一步验证哪些残基构成了益康唑结合袋,团队利用相对高通量的非洲爪蟾卵母细胞双电极电压钳技术(TEVC),依次将假定的结合袋的每个区域的一个残基突变,类似于减法实验,测试其影响。结果显示Phe425Ala参与益康唑的结合,而Leu460Ala,Ile486Ala和Ile565Ala并非参与益康唑的结合,其中后两者可能有益康唑结合之外的其他途径达到抑制效果。
有趣的是,相似的残基口袋在TRPV的其他蛋白中也发挥作用,如通过修饰这些关键残基,使TRPV2通道从对香草酸不敏感转换为敏感。与TRPV5的Phe425类似,TRPV1有极性的Ser513,TRPV2有疏水的Phe467(鼠)或Phe470(兔),见图4(中、右)。
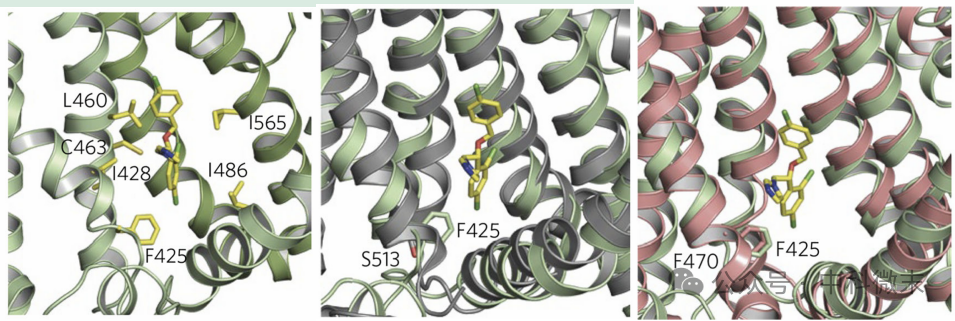
图4 TRPV5残基口袋(左),与TRPV1(中)、TRPV2(右)的配体结合口袋对齐的益康唑结合口袋(注:氨基酸缩写:Phe=F,Ser=S,Leu=L,Ile=I)
4. 在益康唑存在下的TRPV5离子渗透孔
TRPV5离子渗透孔的组成为S5-P-S6(相对位置见图3(左和中)),其中钙离子以灰色网格显示,相对位置如图5(左)。从细胞外自上而下观察结合益康唑的TRPV5的四聚体的选择性透过膜,钙离子的密度以灰色网格显示,虚线表示从Asp542(Asp=D,天冬氨酸)氧原子中心到钙离子中心的长度为3.5埃,结合钙离子直径为2.28埃,推测有水分子的参与,形成水合钙离子与透过膜相互作用,比例约为:1个钙离子+4个Asp542+1到2个水分子。细胞外观静电图(图5(右))中,蓝色表示阳性、部分阳性的区域,红色表示阴性和部分阴性的区域,这表明细胞外的前庭(vestibule)为电阴性,将阳性的钙离子引导向选择性透过膜。
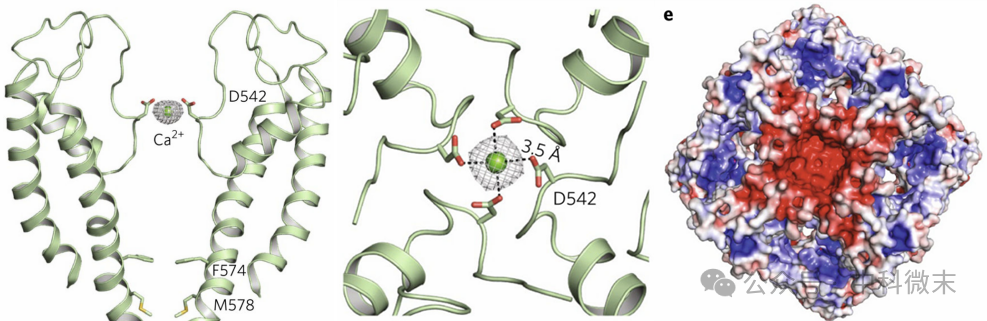
图5 结合益康唑的TRPV5二聚体的孔的卡通图示(左),结合益康唑的TRPV5的四聚体的选择性透过膜,自上而下(细胞外)视图(中),结合益康唑的TRPV5的细胞外观静电图(右)
TRPV5的下门(Lower gate)区域如图6(左)所示,在益康唑的抑制作用下,TRPV5的下门紧密关闭,表现为Phe574、Met578和His582位置的内螺旋束将孔径收缩到His582处约为4.5埃,如图6(右)所示的位置;因为阻碍钙离子流动,TRPV5的孔不导电。
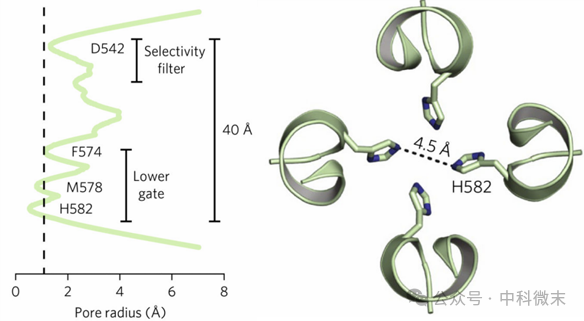
图6 结合益康唑的TRPV5的孔隙轮廓半径(虚线表示非水合钙离子的半径,左),从上至下观察His582处孔最紧的收缩点(虚线表示原子中心之间的距离,右)
三、总结——益康唑抑制TRPV5的机制
通过冷冻电镜,团队观察到结合益康唑的全长的TRPV5通道具有域交换体系结构,这种结构也是所有已被确认的TRP通道在原子分辨率下特有的。同时,TRPV5的孔隙结构表明与其它钙离子选择性离子通道一样,通过与水化壳的相互作用、而非直接与钙离子相互作用来选择钙离子。
在机制上,益康唑结合到TRPV5的S3-S4螺旋、S4-S5连接体和相邻亚单位的S6螺旋的保守的疏水口袋,使S1-S4螺旋束和S4-S5连接体一起向远离孔轴方向运动,进而导致连接S6螺旋和TRP结构域的环(loop)发生构象变化,这个环的运动导致下门收缩关闭,尤其是保守残基Phe574、Met578和His582进入孔的旋转造成孔隙的缩小、甚至阻塞。此外,这个环的活动在TRP结构域产生了额外的构象变化,导致通道的锚蛋白重复序列发生较大的垂直和旋转运动。有趣的是,这些由益康唑引起的构象变化对TRPV5通道的外孔区域或选择性透过膜没有显著影响,这点与TRPV1不同(存在涉及的外孔区域:炮塔区域)。
图7显示了TRPV5在益康唑(ECN)作用下构象的变化,TRPV5三种颜色所代表的结构域见图3(左),其中红色箭头表示TRPV5从不受抑制状态到受抑制状态之间变化。
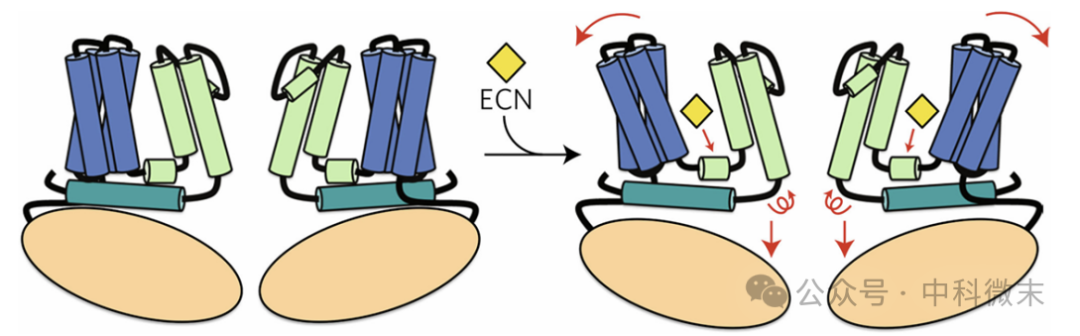
图7 益康唑抑制TRPV5的机制示意图
四、“秘籍”之贵贵在抑制机制:本文价值
已有的研究和结构只表明钙离子渗透的机制,但没有提供有关配体结合,调制和通道门控的信息,而本文中团队获得了全长的TRPV5的原子结构以及小分子如何在分子水平上调节TRPV5。
具体来讲,周正洪教授及团队合作的本研究报道了4.8埃分辨率下、在益康唑存在下全长的TRPV5通道的低温电镜结构,通道跨膜区域的局部分辨率为3.5-4.0埃。这种全长TRPV5结构表明,与其他TRPV亚族成员一样,该通道采用了许多电压门控离子通道常见的域交换结构。这种结构描述了TRPV5通道的抑制状态,并允许鉴定假定的益康唑结合位点。基于现有的TRPV通道结构信息,结合分子动力学模拟在膜的模拟环境中对结合益康唑的TRPV5结构的能量精化,团队首次深入了解了TRPV5抑制的机制。
以上成果对于理解TRPV通道门控机制、生理功能之间的结构多样性至关重要,为高钙尿和肾结石的新靶向治疗打开了新的道路。
五、冷冻电镜技术解析生命奥秘
在研究过程中,冷冻电镜发挥了巨大作用:冷冻电镜使团队能够在水环境中对TRPV5进行清晰成像,并避免潜在的蛋白质结晶伪影,比如一些可能与生物学无关的晶体包装造成的影响。从TRPV1到如今的TRPV5乃至更多通道蛋白的观察,冷冻电镜作为结构生物学技术中蓬勃发展的一员,为揭示生命现象背后的奥秘做出了不可磨灭的贡献,使蛋白质的结构解析变得不那么遥不可及。
中科微末作为国内结构生物学与人工智能技术的探索者,已充分认识到提供优质结构解析服务对于生命科学研究的重要意义。中科微末依托自主研发的冷冻电镜技术,专注提供结构生物学研究服务,实现目标蛋白原子级高分辨率的结构解析。中科微末团队在冷冻电镜技术方面积累了大量算法与专利,可提供“高难度结构解析有解决方案,低难度结构解析更迅速、价格更优惠”的技术服务。展望未来,中科微末将继续致力于冷冻电镜技术的研发和创新,持续推出更多切合客户需求的结构解析解决方案。
①参考Na T, Peng JB. TRPV5: a Ca(2+) channel for the fine-tuning of Ca(2+) reabsorption. Handb. Exp.Pharmacol. 2014; 222:321-357. 和Nilius B, et al. Pharmacological modulation of monovalent cation currents through the epithelial Ca2+ channel ECaC1. Br. J. Pharmacol. 2001; 134:453-462。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流




 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง




