

2月16日,太平洋东岸传来好消息,全球首款TIL疗法Lifileucel获FDA批准上市,为这个寒冬增添了一份暖意。
这不仅是全球首款获批上市的TIL疗法,也是首款获批治疗实体瘤的t细胞疗法,具有里程碑式意义。
肿瘤浸润淋巴细胞(TIL)疗法是一种基于患者自体肿瘤浸润淋巴细胞的细胞药物,它具有肿瘤特异性靶点丰富、肿瘤趋向性好、浸润能力强和副作用小等优点。
已有大量临床证据证实,TIL疗法对黑色素瘤、头颈癌、宫颈癌、非小细胞肺癌等实体肿瘤有着独特的优势。
除Lovance外,国外还有Achilles Therapeutics、Instil Bio、Obsidian和Turnstone等公司布局,我国的劲风生物、沙砾生物、君赛生物、西比曼生物、卡替医疗、蓝马医疗、百吉生物也不甘落后,在积极探索其在其他实体瘤治疗领域的潜力和价值。
以下为全球临床阶段的TIL主要管线:
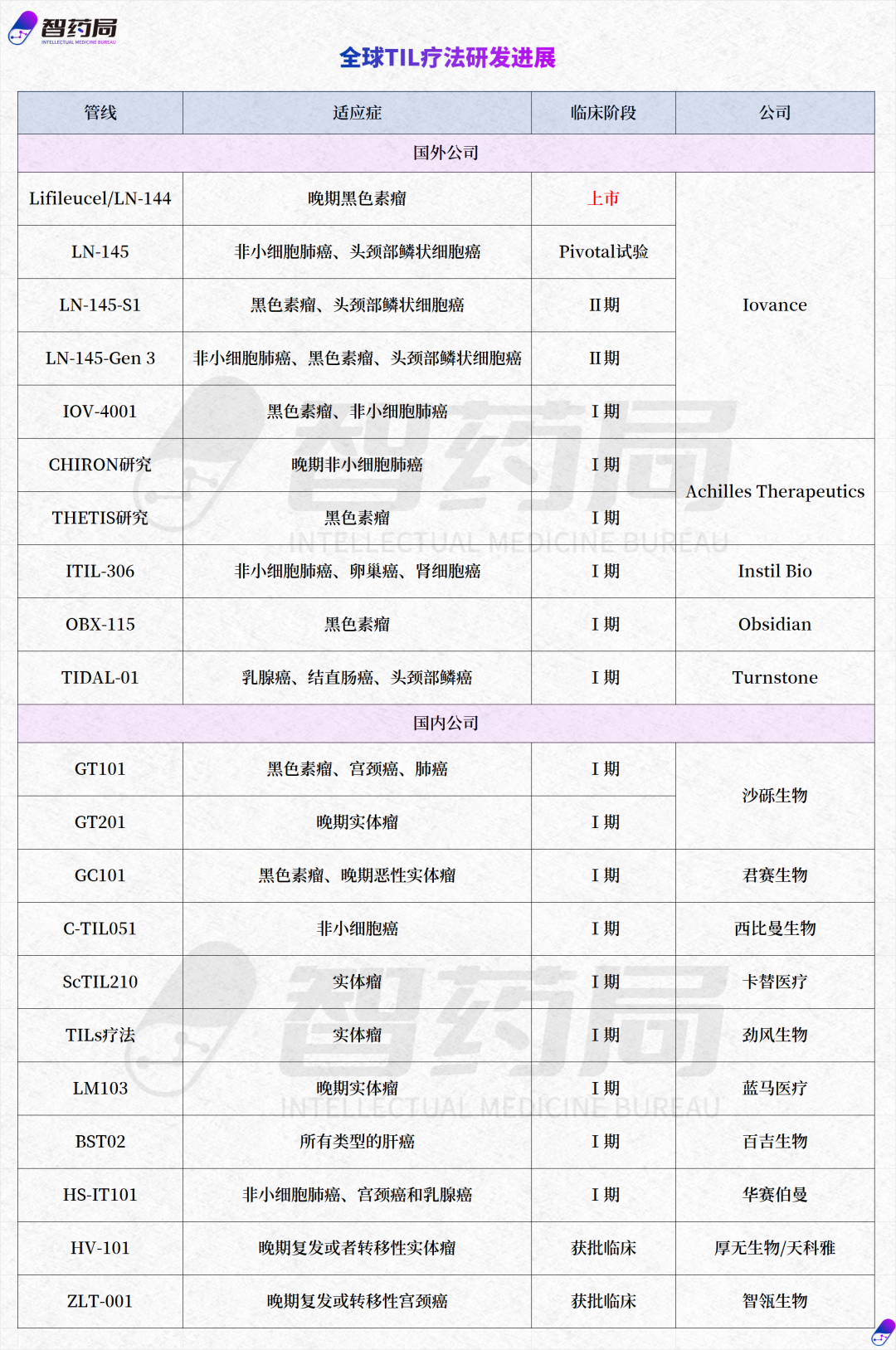
整体而言,由于生产工艺难度高,于CAR-T疗法相比,全球TIL疗法处于仍处于发展初期,多数管线处于临床Ⅰ期,且获批临床时间较短。正是因此,在制备工艺、临床路径等方面,也为创新企业提供了广阔的探索空间。
众公司中,Lovance处于绝对的领导地位,除已上市的Lifileucel外,其旗下的LN-145已进入Pivotal试验,进展再靠前的两条管线LN-145-S1(pd-1选择性til疗法)和LN-145-Gen 3(第三代til疗法),均已进入临床Ⅱ期。
LN-145已被美国FDA授予突破性疗法认定,用于治疗在接受化疗后复发、转移性或持久性宫颈癌患者。
此外,为了扩大 Lifileucel 的市场覆盖范围,Lovance 一直在测试该产品与抗癌疗法的联合使用,并一直在探索其在其他类型癌症中的使用。
我国处于进展最快的是沙砾生物,其自主研发的 GT101注射液于2022年4月获得国家药品监督管理局(NMPA)的临床试验默示许可,这是国内首个获批临床的TIL疗法。
沙砾生物成立于2019年,自成立以来,该公司已建立TIL药物制备工艺、细胞药物开发体系以及多个应用于下一代TIL药物开发的技术平台。
最为低调的应属劲风生物,该公司成立于2020年,由具有丰富医药科技产品研发经验和企业管理经验的于福利博士发起创立,专注在快速推进肿瘤细胞治疗产品研发和临床应用。
闷声放大招,劲风生物成立不足两年,便将其免疫细胞TIL疗法推进至临床Ⅰ期。
同样值得关注还有西比曼生物,最早成立于2010年,2014年正式在美国纳斯克挂牌上市,成为第一个在纳斯达克上市的中国细胞治疗生物医药科技公司。
2022年10月,西比曼生物宣布FDA批准了公司新型TIL疗法C-TIL051的IND申请,适应证为PD-1抗体难治或复发的晚期非小细胞肺癌。
C-TIL051使用了西比曼生物专有的工艺,比传统制造方法生产的TIL更快、更有效地在人体内达到临床剂量。
从适应症布局看,多条管线对应多种适应症,覆盖黑色素瘤、非小细胞癌、宫颈癌、肺癌、头颈部鳞状细胞癌等广泛实体瘤癌种。
其中,百吉生物旗下的BST02是全球首款进入临床开发阶段的肝癌TIL疗法,是一款从患者自身肿瘤浸润淋巴细胞(TIL)中扩增所得到的T细胞治疗产品,属于过继性免疫细胞治疗技术。
君赛生物的GC101,是全球首个既不需要淋巴细胞清除也不需要IL-2输注的非基因改造TIL细胞治疗产品。
从时间维度来看,2023年是TIL疗法发展元年,国内众多TILS细胞产品的纷纷获批临床,不断取得新的研发进展,拿下多个“首个”记录。
5月,全球首款治疗晚期黑色素瘤患者的肿瘤浸润淋巴细胞(til)疗法–Lifileucel(ln-144 利非伦塞)获FDA优先审批,这是首个向FDA提交生物制剂许可申请的til疗法。
1月,智瓴生物的第二代TIL细胞药物ZLT-001注射液获批临床,适应症为晚期复发或转移性宫颈癌,这是华南区首个获批临床的TIL药物。
该候选产品,智瓴生物采用独特技术进行了纯化,增强TIL活性和对实体肿瘤的杀伤能力,将细胞数量扩增到十亿甚至百亿级以上,从而有望达到回输后快速杀伤肿瘤细胞的目的。
1月,厚无生物/天科雅的HV-101注射液获得临床试验默示许可,用于治疗晚期复发或者转移性实体瘤。
7月,蓝马医疗的LM103注射液获批临床,这是国内TIL领域首个使用滋养细胞(Feeder)工艺的临床许可。
9月,华赛伯曼首款TIL疗法HS-IT101的IND申请获得CDE受理,用于治疗晚期实体肿瘤,于今年1月启动Ⅰ期临床试验。
HS-IT101是一款加强TIL,主要通过优化工艺,实现从少量肿瘤组织中制备出临床回输所需剂量,同时减少IL-2用量,降低副作用,减少生产时间。
10月,百吉生物BST02的I/II期临床试验申请获得美国FDA批准,用于治疗所有类型的肝癌,是全球首款进入临床阶段针对肝癌的TIL细胞治疗药品。
总的来说,国内TIL疗法进入高速发展阶段的趋势是一个积极的信号,有望为肿瘤患者带来更多治疗选择和希望。然而,同时也需要关注产品质量、安全性、成本效益等方面的问题,并加强对于临床应用和市场监管的监督和管理。








 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง





