
点击蓝字 关注我们

微末生物
Nanomega BioAI
前言
令人苦恼的“水泡”总是与烦心事接踵而至。在北方的冬天,人们的嘴唇以及嘴角、额头等部位时不时就会出现几个小泡,有点痒,甚至还可能会疼痛。尽管大约一个星期就会痊愈,但过了一段时间,这些小水泡又会“顽强地”出现在同一部位上。在民间,我们经常把这种现象归因为“上火”——由精神压力、疲劳等因素引起的,在面部皮肤黏膜出现的泡状或溃疡性病变。
水泡的“反复拜访”可以说是无数人的“心头病”。究竟谁才是引发皮肤“小水泡”的元凶?喝茶,或是服用清热解毒药物,能够将其彻底治疗吗?
实际上,我们到医院检查时,看到这种较为常见的“小水泡”,医生一般会说这是“单纯疱疹发作”。从科学的角度上看 ,引起水泡的元凶其实是【单纯疱疹病毒】。单纯疱疹病毒(herpes simplex virus,HSV)是疱疹病毒中的典型代表,由于在感染急性期发生【水疱性皮炎】而得名。据调查,全球大约有90%的成年人有过单纯疱疹的病毒感染,多数症状表现为局部的簇状小水泡,内含透明疱疹液。它能引起多种人类疾病,如龈口炎、角膜结膜炎、脑炎,甚至是生殖系统感染。
冬天天气寒冷,人体免疫力难免降低,这一病毒便会“趁虚而入”。在感染宿主后,它经常能够在神经细胞中“潜伏下来”;而受到激活后则会再度引发病症。疱疹病毒经常在无症状的状态下进行排毒,在人群中维持传播链。这使得疱疹病毒能够周而复始地循环、复发。
在与“小水泡”作斗争时,我们也不妨看一看这病毒的“真正面目”——加州大学洛杉矶分校(UCLA)的周正洪教授所在的团队合作在Science上发表文章Seeing the Herpesvirus Capsid at 8.5 Å,用冷冻电镜观察了单纯疱疹病毒HSV-1的衣壳蛋白复合物。这一研究揭开了单纯疱疹病毒神秘的面纱,并且观察到病毒衣壳结构中一种前所未知的,也是HSV所独有的蛋白复合物类型——三联体。
一、单纯疱疹病毒与疾病
人是单纯疱疹病毒的自然宿主,人群中感染极为普遍,初次感染中的80%—90%为隐性感染,大多无明显症状;少数为显性感染,常见的临床表现为黏膜或皮肤局部的疱疹。初次感染后多转为潜伏,受外界刺激后可引起复发。传染源为患者和带毒者,传播途径为直接接触或性接触,病毒可以通过破损皮肤、黏膜启动感染。
根据抗原性的差别,HSV分为HSV-1和HSV-2两种血清型。两型病毒的DNA有50%的相似性,具有共有抗原和特异性抗原。我们平时熟知的“水泡”主要是感染了HSV-1,而妊娠期妇女如有HSV-1感染,病毒可能经胎盘感染胎儿,造成流产、早产、死胎或先天性畸形。外生殖器处的疱疹和75%的新生儿疱疹则主要由HSV-2感染引起,HSV-2感染与宫颈癌的发生也具有密切关系。研究表明,宫颈癌患者体内抗HSV-2抗体阳性率高;而且患有生殖器疱疹的妇女,其宫颈癌的发病率明显升高。
二、揭开单纯疱疹病毒神秘的面纱
HSV-1病毒颗粒(图1)由含有糖蛋白的包膜、蛋白质层(外被)和直径为 1250 Å 的二十面体衣壳组成,包住双链 DNA (dsDNA) 基因组。
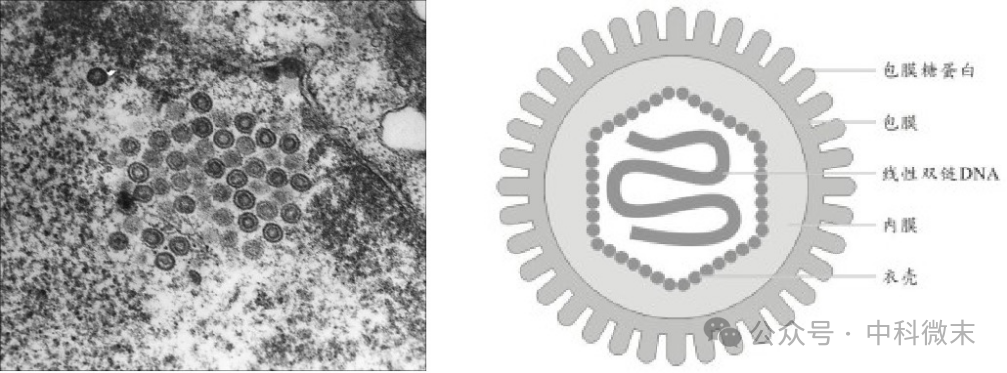
图1:HSV-1的透射电镜下形态和结构示意图
本篇文献中,研究人员在 JEOL 4000 电子冷冻显微镜中使用 LaB6 枪在 400 kV 下操作,对冰包埋的 HSV-1 衣壳进行成像,最终以 8.5 Å 的分辨率确定了病毒衣壳的分子结构。
衣壳总分子量为 2 亿道尔顿,主要由四种不同的病毒蛋白(virus protein,VP)形成:VP5 (149 kD)、VP26 (12 kD)、VP23 (34 kD) 和 VP19C (50 kD)。这四种蛋白主要以【五联体】和【六联体】两种形式聚集而生,组装形成病毒衣壳的全貌:一个“结构单元”包含1个五联体亚基+15个六联体亚基+起连接作用的多个三联体亚基(图2)。在成分上,五联体包含 5 个VP5拷贝,而六联体则包含 6 个 VP5 拷贝和 6个较小的VP26 拷贝。VP26在 VP5 亚基顶端形成一个“连接环”(图3)。
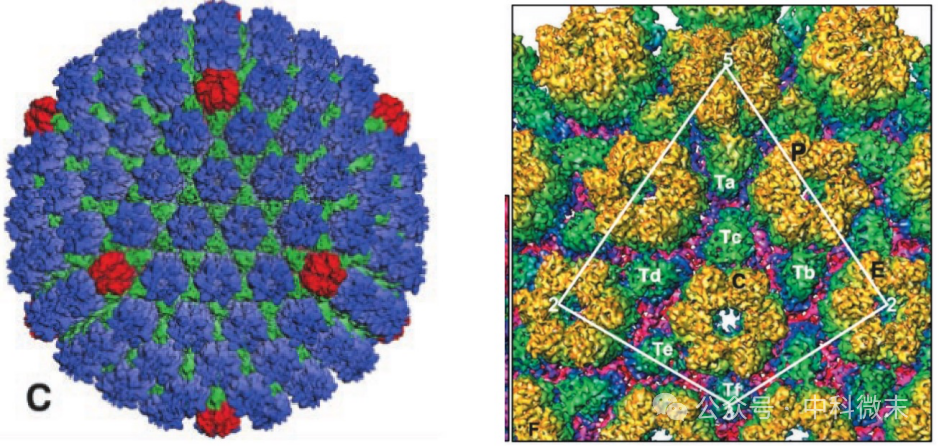
图2: 衣壳的阴影表面视图,具有 12 个五联邻体(红色)、150 个六联邻体(蓝色)和 320 个三联链体(绿色)
右图为局部放大,白色线框起来的部分显示了一个结构单元
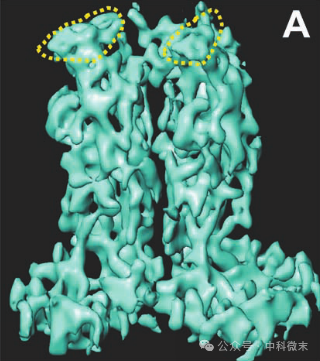
图3:两个六联体的冷冻电镜显微结构,其中虚线外为较大的VP5蛋白,虚线内中为VP26蛋白5结构图
在六联体的 VP5 亚基中,研究人员确定了24 个α螺旋,占其总质量的17%;在VP26 亚基中则不包含明显的螺旋结构。VP5 亚基的上部结构域存在两个相对较长的螺旋(20 和 22 Å)。在中间区域可以看到一组七个相对较短(8 至 14 Å)、几乎平行的α螺旋(图4)。
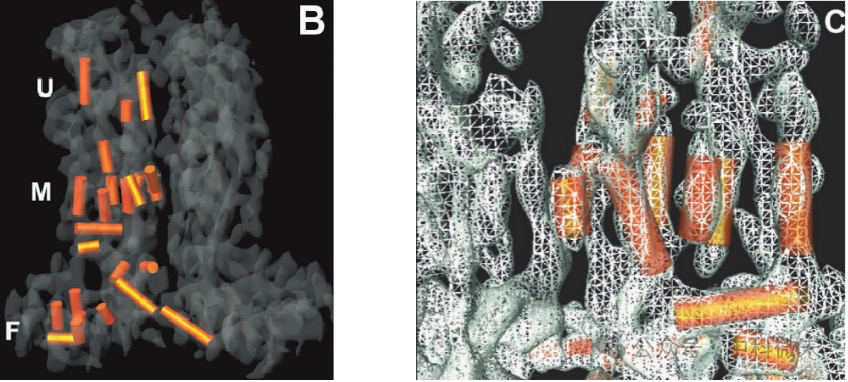
图4:六联体亚基 (VP5蛋白中确定的α螺旋结构,以及示意图)、(VP5中间部分七个近乎平行的α螺旋结构
五联体和六联体都围成“通道”样结构,而在五联体中,这种结构被认为在病毒成熟和DNA包装过程中起重要作用。在VP5蛋白间相接触的底层结构域中,一个长螺旋(~22 Å)通过轻微弯曲与另一个长螺旋(~26 Å)相连,后者延伸到相邻亚基的底层结构域中。多种证据表明,这种“将末端螺旋片段插入相邻亚基”的形式可能就是病毒维持其衣壳稳定性的分子机制(图5)。研究人员之前发现,构成底层结构域的 VP5 的总体结构在衣壳装载基因组DNA的前后发生了显著的变化 。显然,这些螺旋的空间排列将受到病毒生活状态的影响。
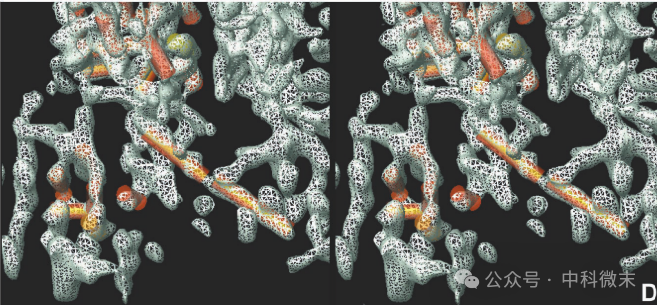
图5: VP5亚基之间起相互连接作用的长螺旋结构(局部放大图,橙色)
除了主要的五联体和六联体,还有一种【三联体】也是病毒衣壳的重要结构。在 HSV-1 中,三联体被认为是一个 VP19C 和两个 VP23 分子组成的异源三聚体。
三联体下方的底部结构域表现出明确的【三重对称性】,该区域主要由来自三个周围六联体的VP5蛋白;三联体下三分之一的密度也维持了这种【三重对称性】,因为两个 VP23 和一个 VP19C 在此处“三分天下”,占据着等效位置;而到三链体的上部,则没有显示出“三重对称”样的证据——这一部分为VP19C蛋白所全部占据(图6)。
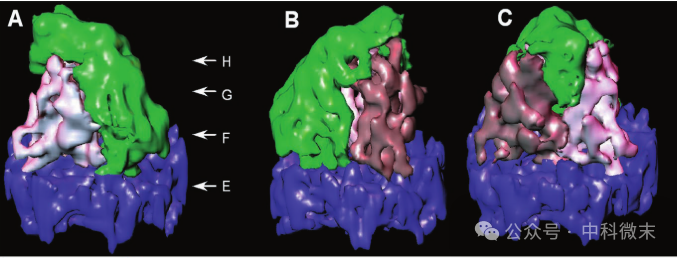
图6: VP19C(绿色)、两个 VP23 分子(粉白色和棕灰色)以及由 VP5 域形成的底板(蓝色)
研究人员在 VP19C中识别出五个短α螺旋(5-8 Å),而每个 VP23 包含三个长(19-26 Å)α螺旋。他们还发现,尽管这两个VP23分子的总体特征保持一致,但一些大的结构域发生了变化。三联体中两个同样的VP23 分子所表现出的“不同构象”体现了同一蛋白质在组成特定复合结构的时发生的【结构适应】(图7)。这种基于蛋白质柔性的“构象适应现象”是病毒衣壳蛋白结构中反复出现的主题。“结构适应”也解释了前人观察到的一个现象:VP23单独存在时是一种模糊不清的“熔球状”,但在复合物中却呈现出确定的三维结构。
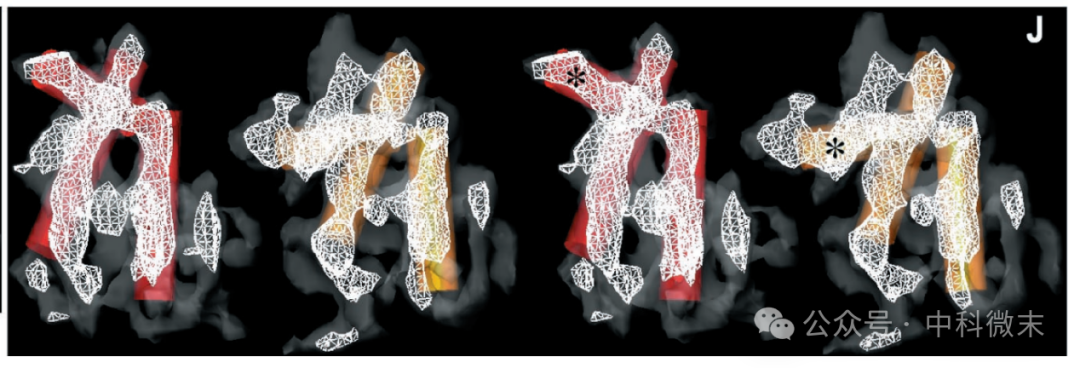
图7: 同一个三联体中两个VP23蛋白(红色,黄色)的不同形态(由星号标出)
疱疹病毒中的这种“三联体”代表了一种以前未知的蛋白质复合物类型。它具有独特的四级结构排列,这是由于亚基互相聚合而导致蛋白发生“结构适应性折叠”而产生的。
看到这里,读过我们往期文章的朋友可能已经发现——这次的病毒蛋白的结构解析结果,和我们之前几期所展示的那些精美、漂亮、细致的结构模型略有不同。实际上,这项研究的进行发生在2000年左右的世纪之交,而这篇science文章正式发表于2000年5月,距现在已有24年之久。周正洪教授所在团队早在24年前,也就是在冷冻电镜发展的初期阶段,就已经成为探索和使用这一先进结构解析技术的“开拓者”。尽管这篇文章的分辨率和细节处理在当今看来已经不能算是完美,但在当时,在冷冻电镜“小荷才露尖尖角”的时期,无疑是一项克服了诸多困难的重大成就。
病毒衣壳蛋白三维结构的解析,对病毒生物学本身的进展,乃至应用方面的药物研发和临床治疗都有着关键的指导意义。中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物大分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


