
点击蓝字 关注我们

微末生物
Nanomega BioAI
在前期的文章中,我们曾经介绍过一种外貌形似“注射器”,由铜绿假单胞菌(Pseudomonas aeruginosa,又称绿脓杆菌)分泌的「分子导弹」——R型脓杆菌素。
这种分子和噬菌体的外形比较类似,但体积又远小于噬菌体;当它被细菌细胞分泌出去,并且接触到目标细胞的“靶蛋白”时,就会如同「开枪」般触发其外鞘蛋白的协同收缩,和内部管道的迅速弹出;而尖端带有金属离子的内部管道在这种“能量爆发”下能够一举穿透目标细胞,造成对于细胞生物来说足以致命的「穿孔」伤害。
上次我们讲到,在那篇Nature子刊文章中,来自加州大学洛杉矶分校(UCLA)的周正洪教授团队通过使用冷冻电镜解析R型脓毒素的外鞘和内筒结构,在原子尺度上阐明了细菌巧妙利用“分子逻辑”完成「能量储存」和「外鞘收缩」过程的原理。外壁蛋白独特的“栅格”状排列方式充分利用蛋白质之间连接关系的灵活性,在保持蛋白自身结构不变的情况下,实现了整个外壁协同发生「快速、大幅度收缩」的可能。
(点击上文链接即可跳转)
然而,在当时,研究人员并未完全说明这种协同的、加速的、瀑布般“输出暴击”的导弹过程,是由什么样的分子机制所触发的。换句话说,在识别其他细胞表面受体的时候,是什么样的信息通过蛋白传递上去,最终导致了外鞘的收缩呢?带着这个“进一步”的问题,他们再度踏上了用冷冻电镜探索分子机器运作机理的道路。
2020年,周正洪教授团队再度就脓杆菌素这一主题于Nature发表文章Action of a minimal contractile bactericidal nanomachine。他们通过解析出复合体【衣领】和【底盘】部分更加清楚的三维结构,彻底解开了这一“生物导弹”中全部的“结构密码”,为这种“分子机器”在医学方面的实际应用奠定了重要的基础。
实际上,类似的“注射器”结构,如大肠杆菌T4噬菌体、细菌T6SS分泌蛋白(IV型分泌系统)等分子机器的作用机理,一直是医学、传染病与微生物学,乃至基因编辑领域都非常关心的「重要科学问题」。比如在2023年,麻省理工学院的CRISPR大佬张锋博士就在研究此类“细菌细胞外注射系统(CIS)”的过程中,开发了能够靶向真核生物的全新的蛋白质递送系统,发表了药物递送领域最新的Nature文章。周正洪教授团队在解析这一分子机制时,选择结构最简单、分子体量最小的R型脓杆菌素作为研究对象,利用冷冻电镜一举解开关键位点的高分辨率三维结构,非常清楚地为科学界阐述了这一蛋白乃至大量类似的分子机器触发收缩的“底层逻辑”。
现在,就让我们追随周正洪教授团队的脚步,来看看他们是如何通过冷冻电镜得到了如此复杂而强大的“分子机器”中各蛋白分子的高分辨率三维结构,又是如何一步步分析了不同分子间相互协作的逻辑关系,从而最终解答了这一分子生物学问题。
研究人员首先制备了该分子复合物的样本,并成功获取其冷冻电镜下的2D图像(图1)。可以看到,在样片制备的过程中,很多分子机器都已经被“触发”收缩了,因此原样品中也存在Pre(收缩前),Post(收缩后)之分。为了使问题得到简化,并最大化局部分辨率,他们将整个分子结构划分开来——顶端的“领口”、中段的“主干”和末端的“底盘”三个部分,分别根据收缩前分子的图像进行三维重构,最终将三部分拼接起来,形成完整的、体积相对庞大的“分子机器”。
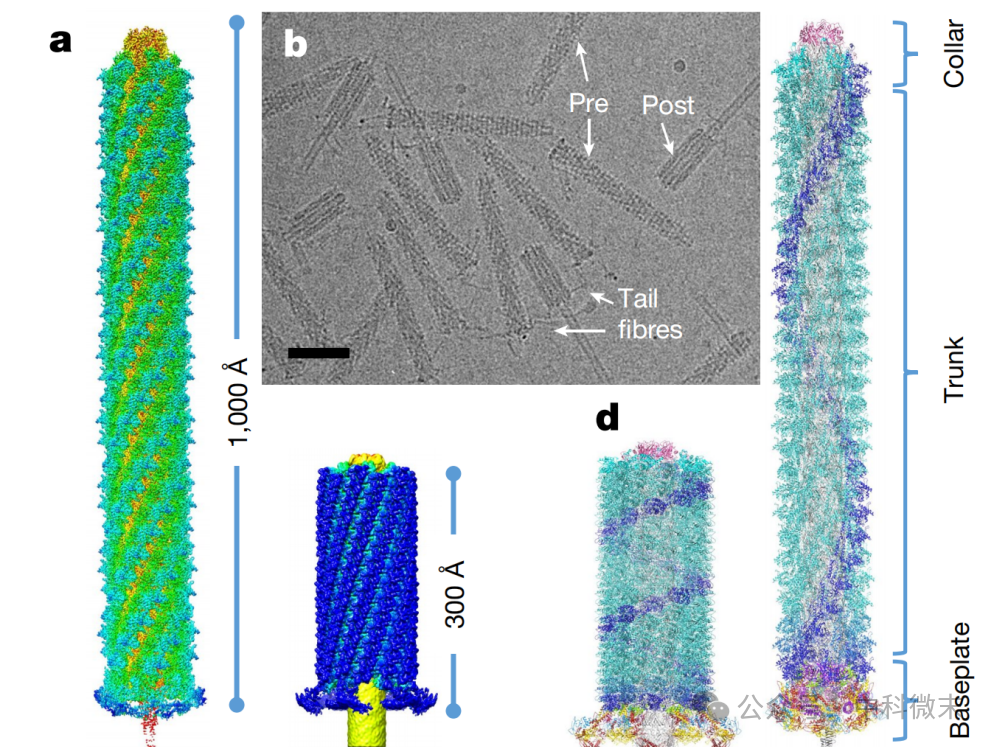
图1:冷冻电镜下的分子状态以及最终搭建出的三维模型
这样得到的分子结构有着非常好的局部分辨结果,顶端达到3.8Å,底盘达到3.5Å,中段更是高达2.9Å,均达到了亚原子级分辨率的水平。这些高分辨率的数据就为接下来的细致分析提供了坚实的物质基础。
整个分子上,仅有“尾丝”部分——没错,就是接在底盘上如同噬菌体尾丝那样的丝状蛋白,没有得到高分辨率的图像。这实际上是因为这一部分的摆动幅度较大。但没关系,对于尾丝这种分子量小、整体柔性不大,但连接端摆动较大的蛋白复合物部分,我们只要把它的结构单独解析出来就好。结合无比精确的X射线晶体衍射(crystal structure)和冷冻电镜得到的模糊范围(Cryo-EM),整个分子的结构被顺利地搭建出来。
“收缩后分子”的模型也采用了一样的模型搭建策略:先使用冷冻电镜解析复合物的分区域结构,摆动较大的小块分子用稳定而高分辨的晶体学数据分析,并对标Cryo-EM数据中的“模糊范围”,最终拼接出庞大的复合物模型。这样就同时利用了冷冻电镜能够解析大分子复合物结构、无需做困难的结晶实验的特点,和X-射线晶体衍射方法适合于解析独立的小分子、结晶解析过程稳定而分辨率高的特点。这样,整个毒素(pyocin)的三维结构就被确立出来。
更重要的是,研究人员还根据原子分辨率数据中“肉眼可见”的侧链推断其氨基酸的成分,并且直接将这些蛋白一一对应到了基因组中的每一个相关基因上。这可谓是“端到端”的一次解析——从三维结构,到分子序列,到对应基因。在这样一个本来是“简单”而繁琐,“重要”而枯燥的问题上面,冷冻电镜几乎把一切都告诉了我们(图2)。
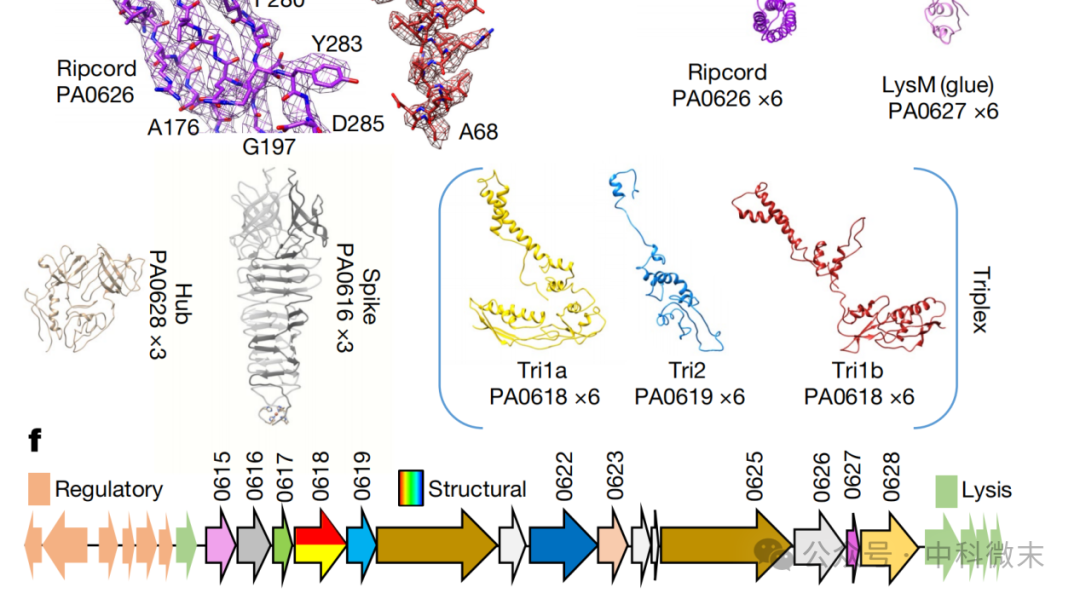
图2: 研究人员使用冷冻电镜的原子分辨率结果将蛋白逐一对应到基因上
在这些结构中,比较简单的是“衣领”(collar,图3),也就是整个“分子导弹”“打桩机”的封顶部分。这一部分一方面连接“内筒”,一方面连接“外鞘”,承担着维持整个分子在收缩过程中相对稳定的作用。因为在穿刺细胞外壁的过程中,整个分子需要释放储存在蛋白质外鞘内部的很多能量。想象一下,如果这种能量释放时分子机器内部的关键连接点无法保持稳定,整个分子就会发生“能量泄漏”,本该集中“全力一击”的能量都因为散架而被浪费掉了。
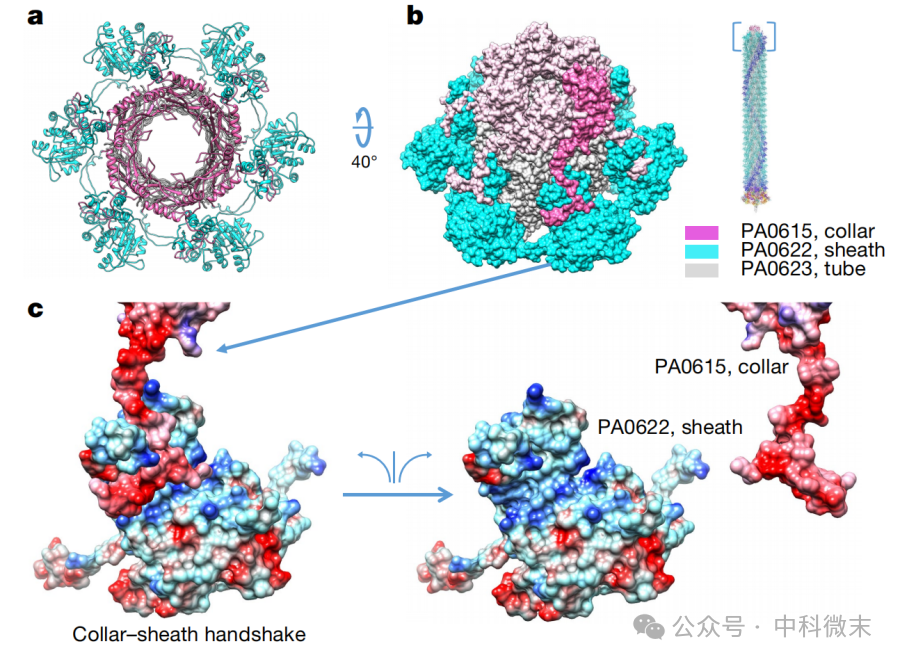
图3:位于复合物顶端的“衣领蛋白”三维结构
从外形上看,衣领蛋白(图3,粉色)围成一圈的蛋白数量和外鞘内筒都相同,是6个一圈。这个蛋白的单体可以明显地分为一个团状的“球形部分”,和一个长条状的“伸长部分”。球形结构域实际上和“内筒”蛋白的结构类似,是内筒的同等延伸;而伸长结构域则是它连接外鞘蛋白的部分。看过我们讲分子导弹(上)的那篇文章的读者应该对外鞘的连接还有些印象:外鞘蛋白的连接方式是“左上+右上+右下”(图4)——三个刚性的蛋白质结构,左上右上各自提供两个“插销”,右下蛋白的顶端提供一个“插口”,来自三个蛋白的部分结构域在此合并,形成结构学上非常经典的“β折叠片层”结构。这样的结构既维持了稳定性,又为收缩过程的进行提供了“空间许可”。
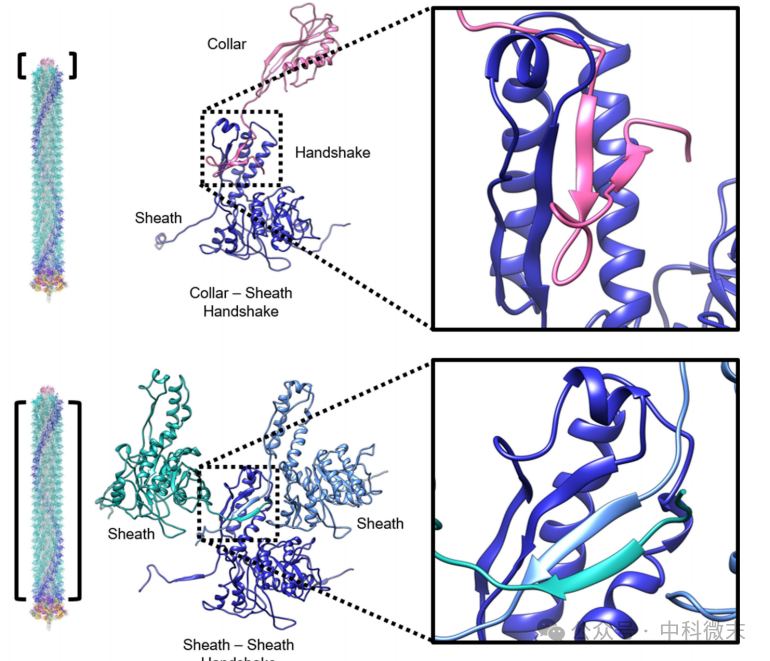
图4:衣领蛋白和外鞘蛋白之间(上)和外鞘蛋白彼此之间(下)的连接方式对比
对比来看,衣领蛋白的连接与之逻辑类似,但也有不同;这一次不再存在横向之间的串联关系,而是由每一个衣领蛋白(collar)提供的“双插销”和下面对应的外鞘蛋白(sheath)的“插口”相结合,同样形成比较紧密坚固的β折叠片层。这样的handshake“握手”结构是贯穿整个分子机器的“构造主题”。
另外,和外鞘间的互作不同,这一“衣领”蛋白还通过蛋白质所带正负电荷之间的相互作用,更加紧密地与下方的外鞘蛋白协作起来,进一步加固了这一重要的承重结构。另外,在结构变为收缩之后,可以明显看到整个外鞘向外展开,直径变大,而内部的“内筒”呈现比较模糊的低分辨率结构,说明整个分子的结构稳定性有所下降。
更引人注目的是整个蛋白复合物“底盘”附近的结构。一切导弹“爆炸”的起始,一切分子收缩活动的触发,都由底盘开始。底盘和分子主干如何连接?底盘如何接受外来信息?
在底盘附近,同样有一个“承上启下”的蛋白,它也延续了内筒蛋白六个亚基围成一圈的结构特性。这就是所谓的“降落伞”蛋白(ripcord,紫色,图5)。灰色部分是内筒主干的结尾,而紫色部分就是我们的“降落伞”。降落伞不仅有和内筒主体类似的球状结构域部分,还有延伸出去的一块,由数个螺旋结构并排组成的“延伸结构域”。其中,沿着中轴线向下延伸的球状结构域部分通过下面的“核心接口”(hub,淡金色)蛋白,连接到起穿刺作用的“尖突”蛋白上。“尖突”蛋白顶端的金属「铁离子」,在冷冻电子显微镜下看得一清二楚。它将如同一把匕首般穿透目标细胞的表面,造成致命的离子渗漏。
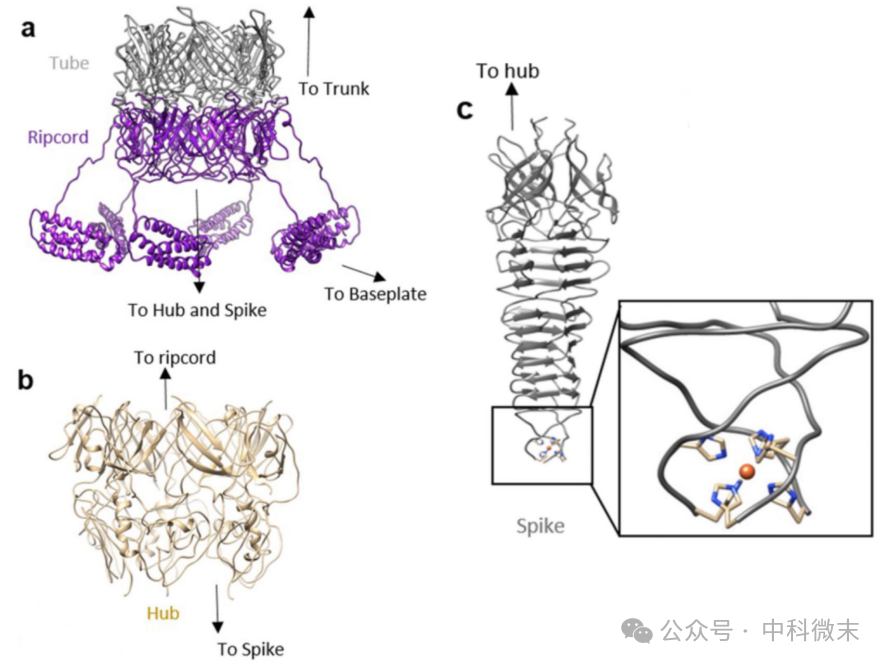
图5: 由冷冻电镜解析得到的“降落伞”蛋白(左上),“核心接口”蛋白(左下),和“尖刺”蛋白(右)结构模型
然而,研究人员通过对在“延伸结构域”部分发生截断的突变体的研究,发现“降落伞”延伸出来的、富含螺旋结构的这一部分,才是解决信号触发之谜的关键。每一个降落伞蛋白的延伸部分,都向下承接着一个“三聚体”复合物(图6)——两个PA0618蛋白(红色,黄色)如同两片面包,夹着中间的PA0619蛋白(蓝色),形成“三明治”样的结构。
在“三明治”的顶端,除了接受来自“降落伞”的螺旋结构域外,它们还和一个小的蛋白“外鞘起始点”(图6,绿色)相接触。这个“起始点蛋白”穿插在最下面一层外鞘蛋白之间,起连接固定位于最下方一层的外鞘蛋白”的作用。另外还有一些小的“胶水”蛋白将“三明治”与“起始点蛋白”固结成较为紧密的结构整体。可以想象,接触对面分子的信号就将从这里传递到外鞘上面。
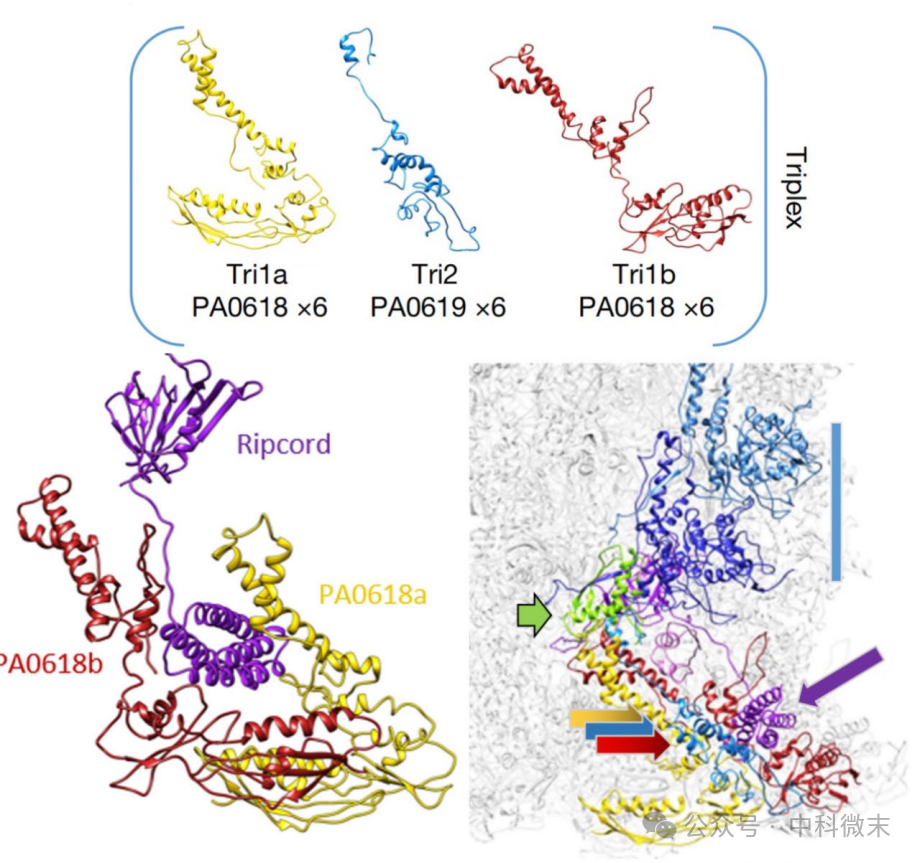
图6: 分子底盘的“三明治”结构及其与“降落伞”之间的连接。三联箭头指“三明治”复合体,紫色箭头指降落伞伸下来的球状结构域,绿色箭头指“外鞘起始蛋白”
在还未发生收缩的时候,底盘部分的六个“三明治”靠复合物末端“手拉手”,互锁形成一个环状的结构,从底端看上去如同动物眼中的虹膜(图7)。而当外鞘收缩,导弹命中,这一圈虹膜扩张,如同瞳孔散开,宣告着目标细胞的死亡来临。
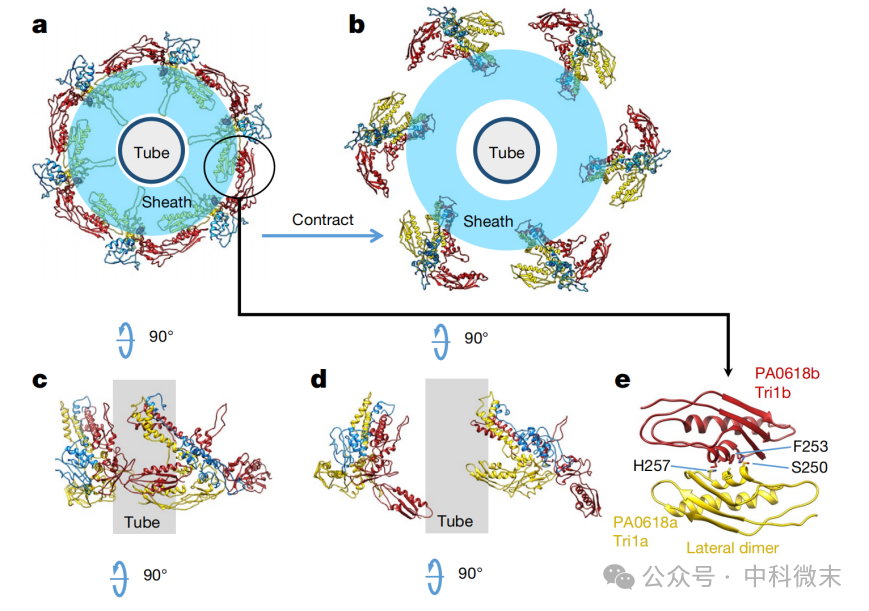
图7: 底盘的“三明治”结构围成一圈,犹如瞳孔。e图显示了“手拉手”式的相互作用
通过分析收缩前与收缩后蛋白复合物结构“螺旋性质”的不同,研究人员发现这些蛋白外鞘发生了一定角度的扭转。当然,这种“旋转”过程可能更有利于内筒如同转头般穿透目标细胞。
最后,结合R型脓毒素的细胞分子学意义,以及蛋白质相互作用的力学关系,研究人员在对比分子机器收缩前后的高分辨率三维结构,构建出了这一蛋白发挥其作用的过程模型:
-
在没有碰到目标蛋白时,复合物的六条“尾丝”部分游离在外。一旦尾丝识别到目标蛋白分子,就将通过蛋白质间相互作用的方式与之结合;
-
结合的一瞬间,产生分子互作的剪切力,就会向斜下方拉动“底盘”复合物。部分平行于细胞表面的拉力迫使底盘复合物扩张其直径,而另一部分垂直于细胞表面的拉力迫使底盘复合物继续向细胞接近。这样的拉伸破坏了“三明治”之间手拉手的脆弱互作;
-
“三明治”复合物之间的互作消失,“瞳孔”散开。散开的三明治复合物进一步拉伸由“降落伞”蛋白上伸出来的螺旋结构域,削弱其结合底盘的强度,降低收缩反应触发的阈值;
-
剪切应力最终通过“起始点蛋白”传递到最靠近尾端的一层外鞘蛋白上面。
于是,在尾丝触发拉力-三明治结构分子-降落伞蛋白脱钩这一系列动作结束后,剪切应力所导致的蛋白质结构变化最终通过三明治的末端传递到起始点蛋白,再由起始点蛋白传递到外鞘蛋白上。这样微弱的受力经过传递和放大,如同火苗一般点燃炸药,使得到信息的外鞘蛋白不再保持与内鞘蛋白之间勉强维系的静电互作,让这种储存在“不稳定性”中的能量一并爆发出来,夺走目标细胞的生命。这就是“分子导弹”运作的全部过程(图8)。
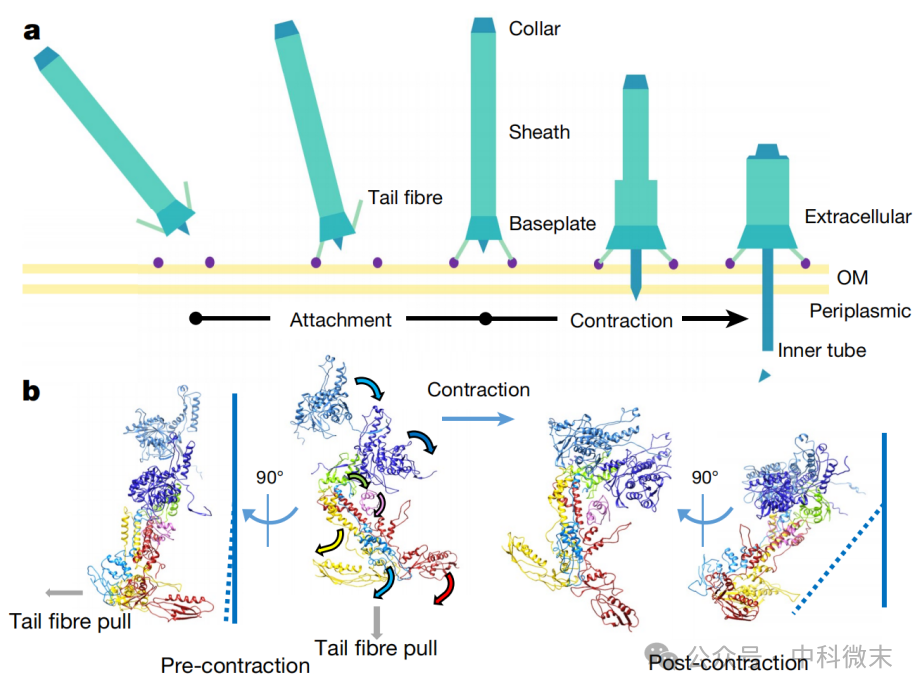
图8:导弹触发的分子机理示意图
然而,冷冻电镜所告诉我们的不止于此。你可以看到,三明治结构之间的分手,也就是瞳孔样底盘六聚物的散开,是触发收缩的关键条件;也就是说,这个“手拉手”部分的稳定性,是整个收缩过程最关键的筹码。在细菌的意义上讲,如果六个尾丝全部结合到目标蛋白,那就是应该杀死的目标,毫无疑问会触发导弹;如果只有一两个尾丝结合到目标蛋白,剩下的部分还会保持稳定,可以“看看再说”。这样“谨慎”的判断方式大大提高了分子机器的“智能性”和“容错率”。
原子级分辨率的数据表明,在这个表面上存在着由组氨酸、苯丙氨酸、丝氨酸等关键氨基酸组成的脆弱互作关系。研究人员合理推测,在酸性环境下(pH=3.5),丝氨酸将会带上正电荷,破坏互作关系。他们制备了蛋白样本,并再次使用冷冻电镜进行了二维图像的成像观察(图10)。统计结果表明,酸性环境确实会诱发分子的“空收缩”。而将这一组氨酸换为苯丙氨酸,可以有效地减小“误触”的概率,提高分子稳定性。
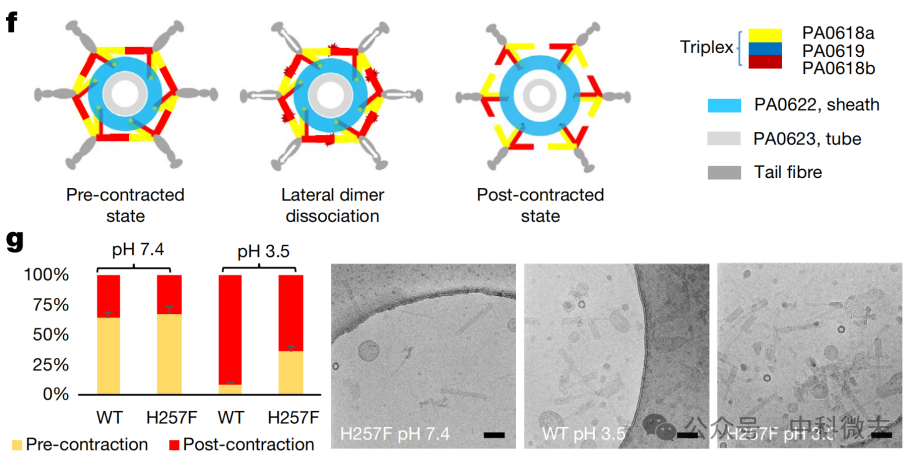
图9: 研究人员使用冷冻电镜成像确定分子状态
如今,R型脓毒素这一分子机器因为其在精确杀伤「指定」病原体方面的强大能力,已经成为创新药物中的新晋“明星分子”。更重要的是,这样的分子机器通过简单粗暴的“打孔”方式来破坏目标细胞,不像通过转运蛋白进入目标细胞的毒性小分子那样容易产生抗药性。在抗生素逐渐失效,超级细菌频出的现在,这一小分子运作机理的彻底阐明,也为人类对抗细菌的手中增添了一道重要的筹码。
对这一分子机器的工程化改造潜力巨大。增加触发部分的稳定性,可以有效提高其“精确打击”的能力;而反过来降低在特定环境中触发部分的稳定性,还可以利用其“范围杀伤”的高效果。与之同类的其他分子复合物还可以被用来发展分子递送工具、药物递送工具等等。从文章中我们可以看出,对于这样的分子机器,无论是在科研团队的分析,还是药厂判定稳定性、判断药品生产效率的过程中,冷冻电镜(Cryo-EM)都因其“眼见为实”的强大功力,发挥着极其关键的作用。利器在手,成果无忧。
中科微末团队在生物大分子及其复合体的三维结构解析方面技术成熟、经验丰富,能够在原子级分辨率解析多种生物高分子材料的三维结构。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
R型脓毒素分子收缩运动的原子分辨率结构模型
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


