今天为大家介绍的是来自McVicker团队的一篇论文。这篇论文讨论了过去十年(2013-2022年)新药批准中与手性相关的趋势。了解和理解新药批准的最新趋势,有潜力启发和促进新药发现的创新。鉴于药品批准的成本,在药物开发初期做出关于药物手性的正确选择,可以节省大量的成本。确定像手性转换和药物再利用这样的做法对患者影响的大小,需要有数据来显示这些做法被利用的频率。

最常见的分子手性类型是由于分子中存在一个或多个立体中心而产生的。碳原子是最常见的立体中心类型,可产生手性。许多药物都是手性的,其手性决定了它们的活性或效力。当一种对映异构体是所需治疗效果的主要或唯一驱动力时,它被称为优异构体,而另一种对映异构体被标记为双异构体。立体化学可以影响药物靶标相互作用、脱靶相互作用、吸收、分布、代谢、消除和排泄。除了药物手性对治疗效果的影响外,手性也影响药物的毒理学特性,而一对对映体展现出截然不同的安全性档案并不罕见。药物开发过程中对映体的选择旨在最大限度地提高治疗效果,同时最大限度地降低毒性。在建立手性药物的安全性时,必须考虑体内手性反转的可能性,这一点至关重要。手性药物分子的对映体对可以使用以下三个类别进行分类:(1)药效体与异构体:在一对对映体中,通常一个对映体(称为药效体,eutomer)具有所需的治疗作用,而另一个对映体(称为异构体,distomer)则效果较弱或没有治疗效果,有时甚至可能产生不良反应。大多数情况下,药物开发的目标是尽可能只使用药效体。(2)两个对映体产生相同效果:在一些情况下,药物的两个对映体可能会产生相同的治疗效果。这种情况较少见,但也存在。(3)手性反转:指的是一个对映体在体内转变成另一个对映体的过程。这种转换可以是单向的(只有一个方向的转换,例如从药效体转换为异构体),也可以是双向的(两个对映体可以互相转化)。
图1中展示了在2013年之前批准的一些著名的手性药物例子,如布洛芬(1,图1)等。
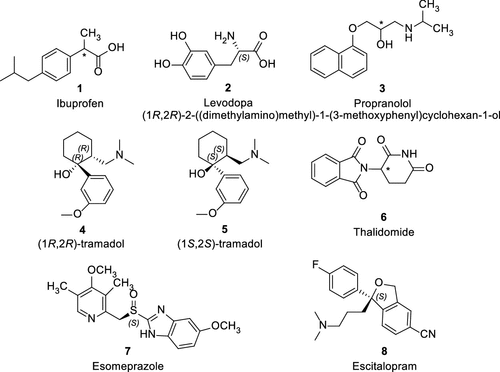
图 1
作者们对最近10年FDA和EMA批准的新药中手性特征的分析和讨论。通过检视这些药物是如何被分类,以及对它们进行了分析,特别是在手性转换的趋势方面。这项工作建立在之前研究的基础上,并扩展到了更近的年份,旨在了解和讨论在药物开发中手性考虑的重要性和实践情况。
美国食品药品监督管理局(FDA)定义新分子实体(NME)为一种化学药物,其不含有之前在美国市场上销售过的活性基团。这个定义不包括生物制品。新的生物药物被FDA称为新生物实体(NBE)。新治疗实体(NTE)这个术语包括了NME和NBE。值得注意的是,手性转换药物可能不会被FDA视为新分子实体,因为纯对映体在之前上市的外消旋体中已存在。在欧洲药品管理局(EMA)中,使用新活性物质(NAS)这个术语。这是一个全面的术语,定义为“在欧盟之前未作为药品获批的化学、生物或放射性药物物质”,或者“之前作为药品在欧盟获批的化学物质的异构体、异构体混合物、复合物或衍生物或盐类,但在安全性和有效性方面与之前获批的化学物质有显著差异”。
FDA新药审批数据
FDA 生物制品和小分子药物批准
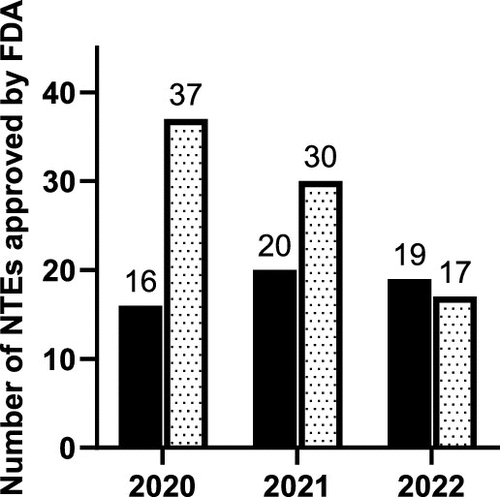
图 2
图2展示了2020年到2022年FDA新分子实体(NME)和新生物实体(NBE)的批准数据。指出小分子药物在新批准药物中的比例有所下降,而生物制品的比例相对增加。但是,由于某些类型的产品被排除在外,这可能影响了生物制品在整体批准中所占的比例。这些数据反映了药物开发和批准趋势的变化,特别是生物制品在新药领域中变得越来越重要。
FDA 核准的对映体、单对映体和外消旋新药
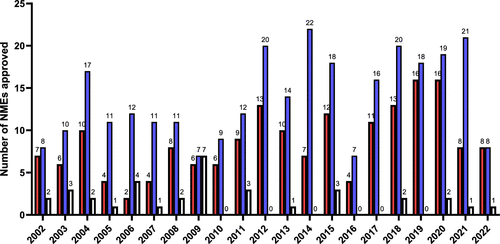
图 3
图3表明,过去二十年内FDA批准的小分子新药中,外消旋体、非手性药物和单一对映体药物的趋势。近十年来,外消旋体药物的批准显著减少,而非手性药物和单一对映体药物的批准比例有所增加。这反映了药物开发中手性的考虑越来越重要,同时也指向了制药行业在药物设计和开发方面的进步。
FDA 新药审批中的手性类型
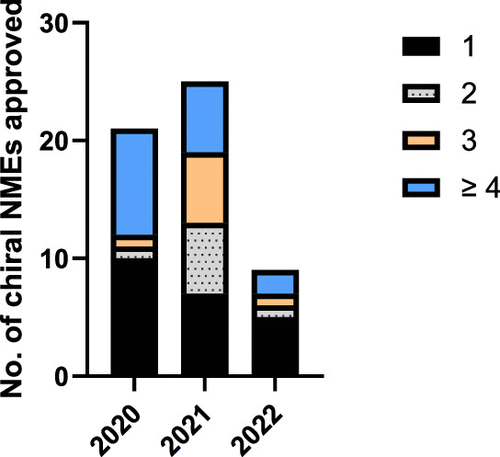
图 4
图4表明,在最近三年中,FDA批准的新手性药物全部包含碳立体中心,显示出大多数手性药物设计倾向于简化的结构,即包含单一立体中心。然而,也有一定比例的药物展现出较高的结构复杂性,即含有四个或更多立体中心,这可能反映了对于某些疾病而言,更复杂的手性分子可能提供额外的治疗优势。此外,这也指出在药物合成中保持或生成正确手性的挑战,尤其是对于那些结构更为复杂的分子。
EMA 新药审批数据
EMA 生物制剂和小分子药物审批
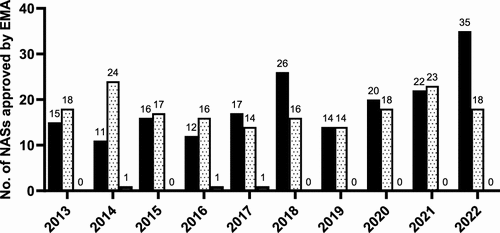
图 5
图5展示了欧洲药品管理局(EMA)在2013年至2022年这十年间生物制品和小分子新活性物质(NAS)批准数据。生物制品在新药批准中的比例逐年增加,而小分子药物虽然在比例上有所下降,但在数量上保持稳定。此外,还提到了少数非传统药物(如聚合物和草药物质)的批准,这展示了EMA在药物批准方面的多样性。
EMA 对映体、单对映体和外消旋新药审批
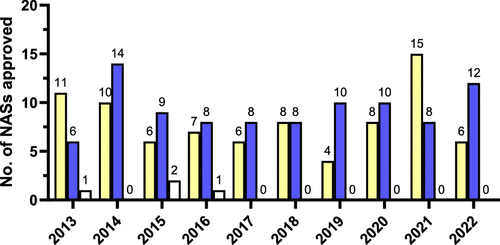
图 6
图6说明了在过去十年中,EMA在手性药物批准方面的趋势。特别是,自2016年以来,没有新的外消旋体被批准,显示出了对于更具选择性的单一对映体药物的偏好。同时,非手性和单一对映体小分子药物的批准数量在这十年中保持相对稳定,反映了在药物开发中对手性的重视和利用。
EMA 新药审批中的手性类型
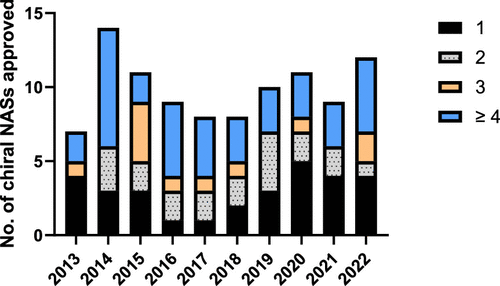
图 7
过去十年EMA批准的手性小分子新活性物质表现出多样化的手性特征,包括外消旋体、单一对映体以及含有不同数量立体中心的分子。这些数据反映了手性在药物设计和开发中的重要性,以及对于保持或改变分子手性的细致考虑。如图7所示,有36种含有≥4个立体中心。
按治疗领域分析的 EMA 药物类型
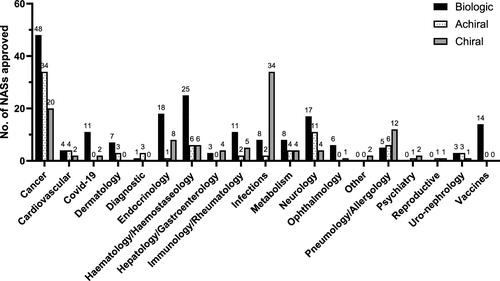
图 8
2013年至2022年的EMA新活性物质(NAS)药物批准根据它们各自的治疗领域进行了分类,并被划分为生物制品、非手性药物或手性药物。图8总结了过去十年EMA批准的新活性物质在不同治疗领域的分布情况,特别强调了手性药物在感染治疗领域的主导地位以及在其他医疗领域的重要性。此外,作者还讨论了在治疗传染病中使用外消旋体相比单一对映体的经济考虑,以及在市场上推广外消旋体的潜在优势。
EMA 和 FDA 数据对比
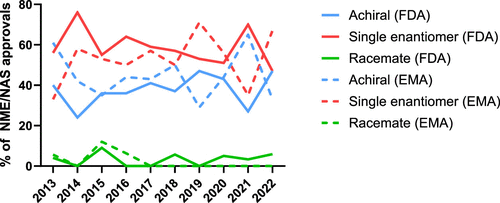
图 9
图9展示了2013年至2022年FDA和EMA药物批准的十年间,非手性、单一对映体和外消旋体小分子NME/NAS批准的百分比(不包括生物制品),表示为所有小分子NME/NAS批准的总比例。说明了在过去十年中,FDA和EMA批准的小分子新药在手性上的趋势。尽管外消旋体药物在FDA的比例略有增加,但在EMA中却没有新的外消旋体被批准,显示了不同监管机构在药物批准方面的不同趋势。同时,非手性和单一对映体药物在两个监管机构的批准中保持了相对稳定的比例,反映了在药物开发中对这两种类型药物的持续重视。
编译 | 曾全晨
审稿 | 王建民
参考资料
McVicker, R. U., & O’Boyle, N. M. (2024). Chirality of New Drug Approvals (2013–2022): Trends and Perspectives. Journal of Medicinal Chemistry.



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


