
点击蓝字 关注我们

微末生物
Nanomega BioAI
前言
“生命不息,运动不止”。生命过程中发生的各种细胞活动,如基因转录、细胞运动、肌肉收缩和感觉传导等,都离不开细胞膜对各种离子通透性的选择性改变。瞬时感受器电位通道(transient receptor potential,TRP)是一类调控阳离子(如Ca2+,Na+等)跨膜流动的「非选择性」阳离子通道蛋白,广泛分布于人外周及中枢神经系统中,并且能够受到一系列化学和物理刺激的调节。
为了进一步了解决定了TRPV通道家族功能的蛋白质三维结构,来自加州大学洛杉矶分校(UCLA)的周正洪教授团队及其合作者在Nature communications上发表文章Structure of the full-length TRPV2 channel by cryo-EM,通过冷冻电子显微镜以~5Å的亚原子级分辨率确定了全长TRPV2蛋白的三维结构。通过利用冷冻电镜(Cryo-EM)解析全长TRPV2的结构,并对TRPV2结构与功能的联系进行分析,科学家们为理解这一庞大蛋白家族功能的多样化及其调节机制做出了重要贡献。
一、 生命的奥秘、庞大的家族
瞬时受体电位(TRP)离子通道是一大类可调控阳离子跨膜流动的非选择性阳离子通道,广泛分布在外周及中枢神经系统。这一庞大的蛋白质家族有6个“家族成员”,分别是:TRPV、TRPC、TRPM、TRPP、TRPA、TRPML。其中TRPV亚家族也由六个成员组成(TRPV1-6)。TRPV1是最常研究的TRPV通道,它可以被有害热量以及内源性和外源性「辣椒素」激活。
辣椒素是辣椒的天然产物,在许多食材中非常常见。在哺乳动物中,辣椒素能够刺激痛觉神经元末梢,导致神经元兴奋,并随后使动物产生疼痛的感觉,在局部释放炎症相关因子。
电生理和生化研究表明,辣椒素通过增加细胞膜对阳离子的通透性,能够使感知痛觉的神经元兴奋;这种对于阳离子的渗透机制同样也可以被过高的温度激活,这也是我们说吃辣的时候会感觉“烫”的原因。TRPV1离子通道蛋白的发现,解释了「辣椒素」刺激痛觉神经细胞的原理,丰富了人们对温度感知和适应周围环境的认识。其发现者David Julius教授也因此获得2021年诺贝尔生理学与医学奖。
同样作为TRPV家族的成员,TRPV2虽然在氨基酸序列上与TRPV1具有接近50%的相似性,却有着与TRPV1截然不同的功能定位。TRPV1位于质膜,并能够被高温以及辣椒素激活;而TRPV2却主要位于「细胞内膜」,而且对热量或辣椒素类化合物没有反应。
在发育生物学上,作为一种离子通道,TRPV2有其独特的作用。之前的研究表明:在胚胎DRG神经元和其他神经元细胞系中,内源性TRPV2在神经元的胞体和轴突内呈现出点状分布,并与Rab7蛋白(一种细胞内膜系统中,晚期内吞体的标记物)共定位。在那里它能够促进神经营养因子信号传导下游的神经元生长。
二、 神秘的通道、神奇的结构
1. 冷冻电镜下全长大鼠TRPV2的结构
尽管TRPV1使美国科学家David Julius于2021年获得了诺贝尔奖;但截然相反的是,TRPV2的运作机理自发现以来就一直难以捉摸。如果能知晓TRPV2的详细结构,将对更深入了解TRPV2的细胞功能提供莫大的帮助。
科学家们通过冷冻电镜单颗粒重建技术,确定了~5Å分辨率的全长大鼠TRPV2的结构。冷冻电镜的三维成像展示了TRPV2于其他TRP通道相似的具有“双闸门”的中央孔道。
图1 展示了全长TRPV2的单粒子冷冻电镜分析。其中(a)是全长大鼠TRPV2的示意图,显示为具有锚蛋白重复结构域(ARD)、S1–S4螺旋、S5–P–S6孔结构域和C末端的二聚体。(b和c)是最终全长TRPV2经过冷冻电镜三维重构得到的图像及其原子模型;(d)是全长TRPV2冷冻电镜图(灰色网格)与对应原子模型(带-棒模型)叠加的一部分代表性区域,包括比较经典的α螺旋和β折叠结构。
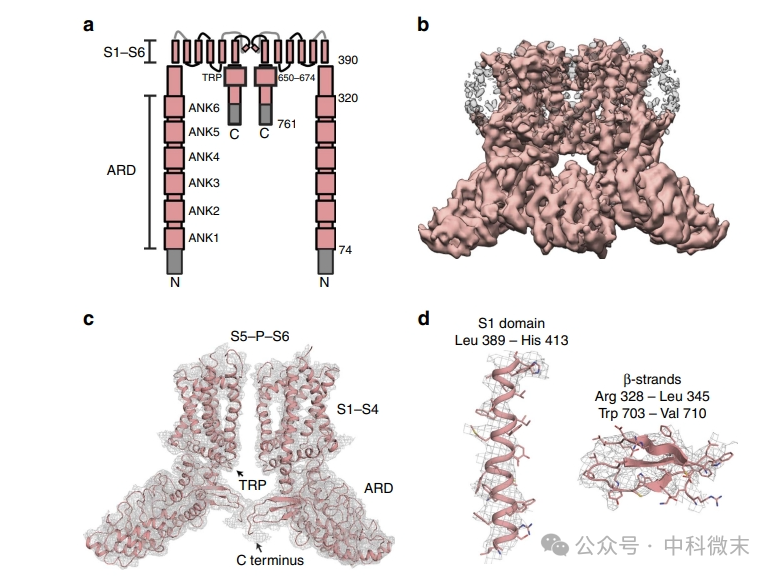
图1 全长TRPV2的单颗粒冷冻电镜分析结果
2. 全长TRPV2的孔道结构
TRPV2的结构和其他TRP通道类似。这一通道蛋白的孔径由两端的两个“闸门”控制:上闸门位于通道外侧的“选择性过滤器”处,下闸门则由S6结构域的远端部分组成(图2A中,两条虚线)。对TRPV2中间孔道部分的成像显示,在不存在配体的情况下,与处在「封闭状态」和「有激动剂激活」下的TRPV1蛋白相比,TRPV2通道的上下两侧都显示出了更宽的“门洞”(图2b-d,两条虚线的数据比a中更小)。而处在未结合配体状态的(apo-)TRPV1的结构,包括上下闸门,都是倾向于关闭的状态(灰色)。
也就是说,在所有状态下,与TRPV1相比,TRPV2的“闸门”都具有更大的碳原子距离(主链上碳原子的间距,代表了蛋白结构间的相对距离)。即使是被RTX/DkTx毒素刺激的TRPV1中以更大幅度开放的下闸门直径,也无法与未接受任何刺激的TRPV2相比。这些结果表明,在静息状态下,TRPV2通道可以让部分水合的Ca2+、Na+和K+离子,甚至于一些直径较大的有机阳离子通过。
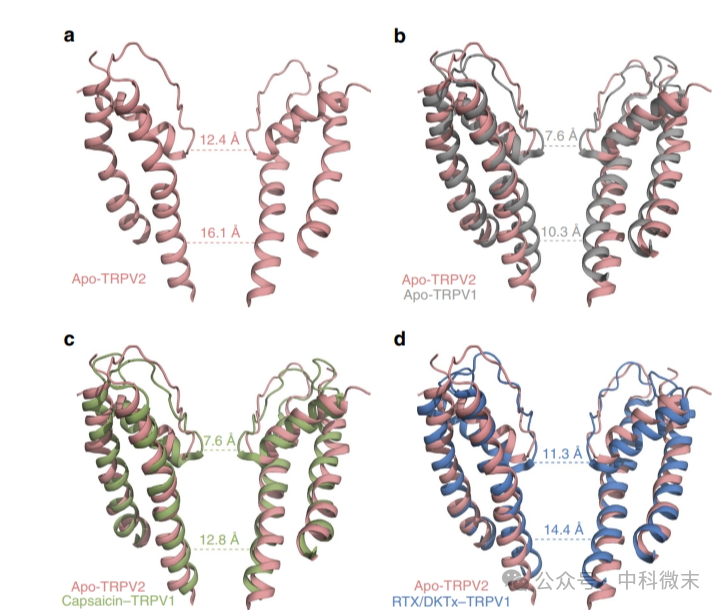
图2 TRPV2离子渗透途径的分析。可见TRPV2的开放程度不仅超过了无激活剂的TRPV1,还超过了有激活剂的TRPV1.(d中,毒蜘蛛产生的多肽毒素(DkTx)、从大戟科树脂分离的树胶脂毒素(RTX)都是TRPV1的另一类强激动剂)
3. TRPV2和TRPV1的结构域和外侧孔道区的比较
我们都知道,蛋白离子通道的开放,是由一系列构象变化引起的。这些构象变化始于将离子通道固定在细胞膜上的锚定部分(ARD),随后将引发上闸门和下闸门的构象变化,并且导致孔结构域相对于细胞内结构域的结构扭转。研究人员详细比较了不含配体状态下的TRPV2 ARD与TRPV1和RTX /DkTx–TRPV1的ARD的位置,以进一步深入了解TRPV2的结构。图3 是TRPV2和TRPV1的锚蛋白重复结构域和外孔区的比较。其中TRPV1为灰色,结合RTX/DkTx分子的TRPV1为蓝色,而TRPV2为粉色。比较(图3,a)这三种蛋白的结构,我们会发现:TRPV1在被激活后,ARD结构域向上发生了大幅度的偏移。而TRPV2在静息状态下,虽然比不上激活态TRPV1的大幅度变化,但也比静息态TRPV1的位置更加靠上。
此外,研究人员还比较了这几种状态下组成孔道壁的蛋白螺旋结构相对于通道中心轴的位置。(图3,b)是这三种蛋白在「外部孔隙区域」的叠加俯视图。在被激活后(灰色-蓝色),可以看到TRPV1的孔道壁发生了顺时针的扭转;而静息态的TRPV2则相对于静息态的TRPV1发生了更加轻度的扭转,程度位于二者之间。
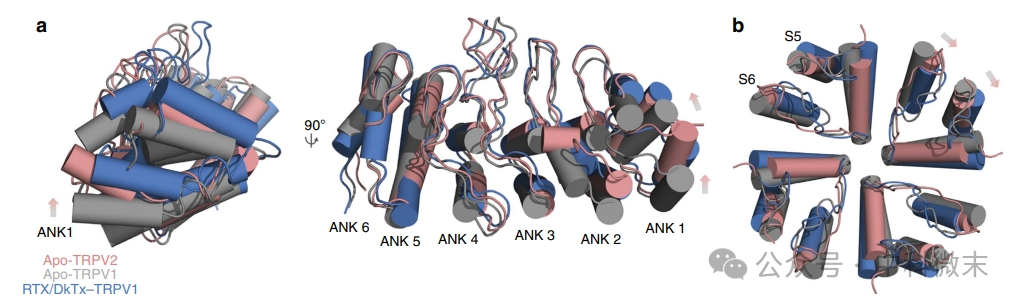
图3 TRPV2和TRPV1的结构域和外孔区的比较
4.全长TRPV2的孔转塔结构域
虽然TRPV1和TRPV2在整个S5、S6、孔道螺旋及其选择性过滤器(Gly–Met–Gly–Asp/Glu)的组成中都有高度的序列同一性,但二者却展现出了截然不同的Ca2+选择性。TRPV1和TRPV2之间“上闸门”的直径差异可以解释两个通道之间阳离子选择性的差异。研究人员进一步推测,这种口径上的大小不同可能是由于这两种蛋白质之间一些固有的结构差异。
连接通道结构域S5与孔螺旋的约30个氨基酸组成一个「环」,称为“孔转塔”(pore turret,图4a,这一部分序列差异较大),与通道门控、大直径有机阳离子渗透和蛋白质通道孔的扩张有关。同源性建模预测,TRPV1结构中“孔转塔”区域的缺失将改变通道分子的孔道区结构,从而可能解释TRPV1和TRPV2之间的一些差异。结果如图4所示,其中(a)是TRPV家族成员的孔转塔区域的序列比对。黑色和青色方框突出显示用于同源建模预测的TRPV1蛋白和兔TRPV2蛋白中较为短小的“孔转塔”区域,而粉色框则突出显示了用于实验验证时鼠TRPV2蛋白中被剔除的相应区域(TRPV2 D564–589)。
图3(c)(d)通过荧光成像和生化验证的方法确认了这一蛋白在细胞中的合成和分布不受影响。研究人员通过Fluo4荧光方法(图3,e)检测不同组别的细胞内钙反应时,可以明显看出:在施加TRPV2的激动剂(2-APB)之后,有正常TRPV2的细胞内钙离子浓度升高(粉色线),而失去了“孔转塔”的细胞毫无反应(黑色线)。最后,研究人员使用冷冻电镜成像的方法确定——失去这一部分的通道蛋白表现出了更狭窄的“上闸门”和“下闸门”。
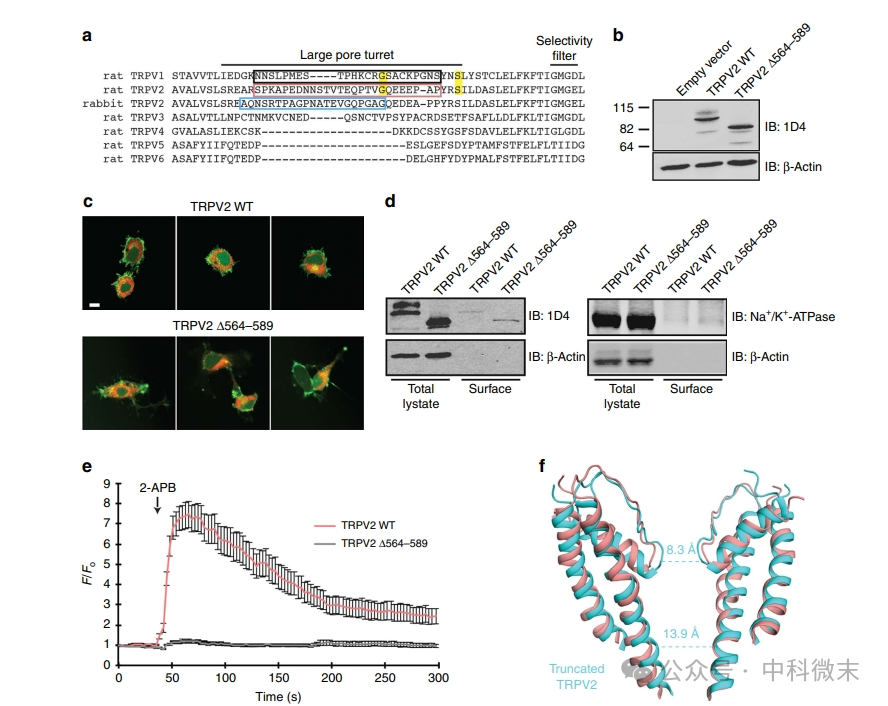
图4 大孔转塔可能影响TRPV2离子渗透途径
5.全长TRPV2结构中的脂质结合位点
组成生物膜的主要分子,脂质,是已知的TRPV家族通道功能的重要调节剂。不过,这种情况已经算是屡见不鲜:我们已经知道很多种离子通道都会受到脂质分子的调节,毕竟“身在脂质中”,想不受到调节也不容易。冷冻电镜成像的数据中,可以看到磷脂分子和胆固醇分子在蛋白的很多位置上与离子通道发生了相互作用。
研究人员在添加/不添加脂质的情况下,使用冷冻电镜对蛋白样品进行了观察。结构差异表明,TRPV通道的S4螺旋区域与脂质的相互作用(生理上的,或在纯化过程中另外添加的)是动态的,可能会对通道功能产生影响。
三、总结--TRPV2的结构特点
在没有配体的情况下,与较短的大鼠TRPV1和兔TRPV2相比,全长的大鼠TRPV 2包含更宽的上下闸门。TRPV2在体内对TRPV1的激活因素如辣椒素和热量不敏感。到目前为止,能够影响TRPV2的内源性调节因子尚不清楚,但它可能受到多种磷酸肌醇的调节,这些磷酸肌醇在细胞内膜中非常丰富。此外,TRPV2活性还可通过翻译后修饰以及通道表达和定位的变化来调节。
实验表明,重组的全长TRPV2在人工脂质体中存在时,有持续通透阳离子的活性,这和结构生物学解析的结果相一致。这种活性可能是TRPV2固有的;然而,其功能仍有可能因为不存在于重组体系中的其他细胞因子(比如可能调节通道活性的多种膜脂质)的存在而发生改变。冷冻电镜数据采集过程中多种影响因子的缺乏也可能影响整个全长TRPV2apo状态下的架构。因此,需要进一步的研究来确定内源性调节因子如何导致与TRPV2激活相关的构象变化。
在这项研究过程中,冷冻电镜发挥了巨大作用。从技术角度来看,冷冻电镜正在彻底改变我们确定解析跨膜通道结构的能力。作为现代结构生物学技术中的中流砥柱,冷冻电子显微镜为揭示生命现象背后的奥秘作出了不可磨灭的贡献,使蛋白质的结构解析变得不那么遥不可及。作者还强调,通过解析全长TRPV2的结构,对有通道激活剂/抑制剂条件下的TRPV2蛋白进行额外的结构分析,以及对其他TRP通道进行结构分析,将揭示这一庞大的离子通道超家族的多种调节机制和功能。
中科微末团队在使用Cryo-ET和Cryo-EM等多种技术解析生物大分子及其复合物的三维结构方面技术成熟、经验丰富,能够在近原子级分辨率解析多种生物大分子材料的三维结构,为您提供“眼见为实”的结构信息。我们致力于为药企和高校医院科研工作者提供一站式、自动化、原子级分辨率的结构解析服务,助力创新药物研发和科研成果转化,帮助科研人员实现“原子结构自由”。
微末生物
Nanomega BioAI

请关注微末生物
期待与您交流



 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


