
研究背景
癌症的发展涉及基因改变和信号通路的失调。大多数癌症在发展过程中都会出现 Rb、p53 和 PI3K/Akt 等常见信号通路的失调。拓扑异构酶Ⅱβ结合蛋白1(TopBP1)常见致癌途径的交汇点发挥作用,被确定为癌症的治疗靶点。TopBP1包含9个BRCT 结构域,参与多种蛋白质相互作用包括参与DNA复制、ATR检查点激活、DNA修复、有丝分裂和转录调控。在进入G1/S期时,E2F1转录诱导TopBP1的表达。在S期和G2期晚期,Akt使TopBP1 磷酸化,影响其相互作用伙伴,并影响复制启动和细胞凋亡。大多数类型的癌症都存在TopBP1过表达的情况,在乳腺癌和卵巢癌中,TopBP1是一个独立的不良预后因素。TopBP1的过表达通过抑制E2F1介导的细胞凋亡、促进突变型p53的功能增益、绕过活性Cdk2以促进DNA复制以及阻碍ATR/Chk1的激活来促进癌症的发展。
钙黄绿素被确定为一种先导抑制剂,可与TopBP1的第7至第8个BRCA1羧基末端(BRCT)结构域结合。钙黄绿素缺乏膜渗透性,因此用钙黄绿素AM(乙酰氧甲基酯)这种细胞渗透性衍生物处理癌细胞。钙黄绿素 AM 在细胞内迅速水解形成钙黄绿素,显示出体内抗癌活性。TopBP1-BRCT7/8已被确定为癌症治疗中具有吸引力的小分子抑制剂靶点。本文通过多轮化合物筛选,发现了一种名为5D4的新化合物。5D4以TopBP1-BRCT7/8为靶点,且在体内具有抗癌活性。
研究结果
1. 分子对接及扩展发现5D4是一种有效的TopBP1抑制剂
本文描述了一种基于晶体结构靶向TopBP1-BRCT7/8结构域的新化合物Cpd 2H3的鉴定和表征。最初的筛选利用了超过2000种已知化合物的分子对接,最终发现了TopBP1抑制剂CalAM和Cpd 2H3。通过分子对接和筛选发现CalAM、Cpd 2H3等先导化合物具有多苯环,可停靠在TopBP1-BRCT7/8的一个口袋中。同时扩大筛选以鉴定具有修饰侧链的Cpd2h3的类似物和衍生物。其中5D4 对多种癌细胞(包括乳腺癌和卵巢癌)显示出很强的细胞毒活性,对非转化细胞的作用很小。细胞热移实验(CETSA)证实5D4在癌细胞中与内源性TopBP1结合。TopBP1的缺失减弱了5D4的抗癌作用,表明5D4的活性依赖于TopBP1的表达。5D4治疗特异性抑制乳腺癌细胞中TopBP1与E2F1、mutp53、MIZ1和PLK1的结合,不干扰TopBP1涉及其他结构域的相互作用,如与RPA2、Rad9、Treslin和BRCA1-BACH1相互作用的结构域。这种特异性表明TopBP1-BRCT7/8是5D4的细胞靶点。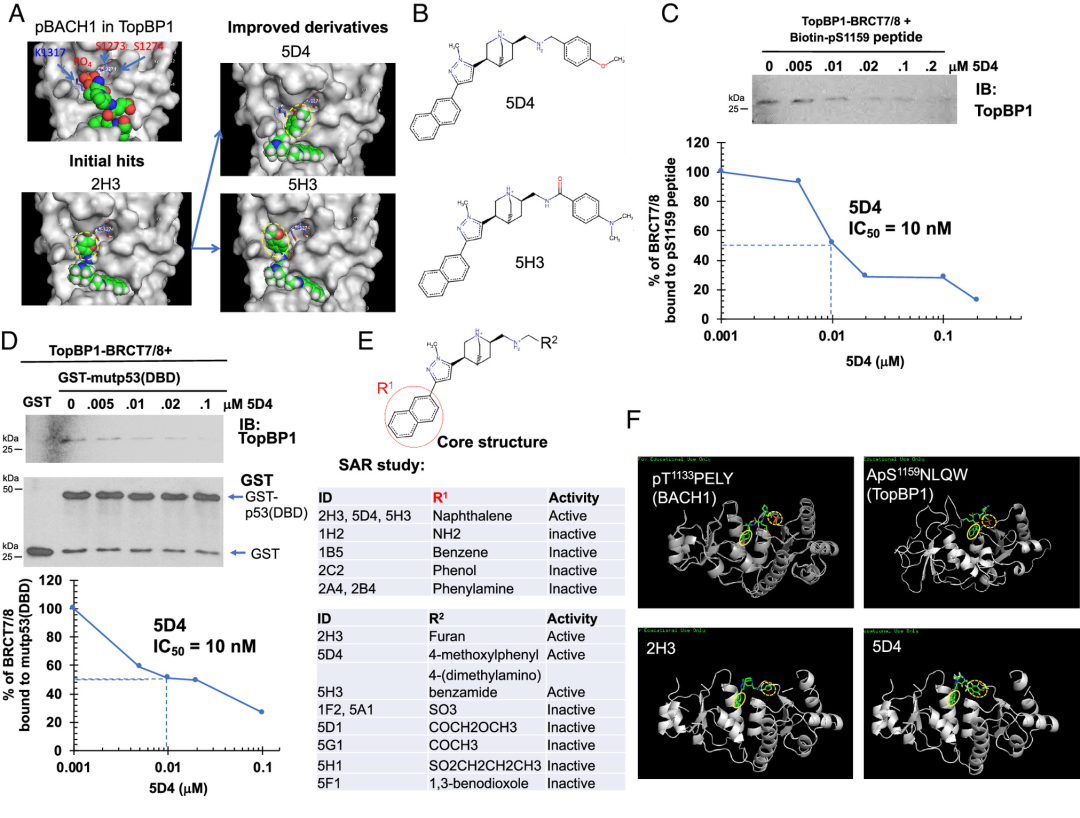 图1 命中扩展和 SAR 研究发现 Cpd 5D4 是一种 TopBP1-BRCT7/8 抑制剂。(A和B)最初命中的 2H3 及其衍生物 5D4 和 5H3 的结构。
图1 命中扩展和 SAR 研究发现 Cpd 5D4 是一种 TopBP1-BRCT7/8 抑制剂。(A和B)最初命中的 2H3 及其衍生物 5D4 和 5H3 的结构。
[1]
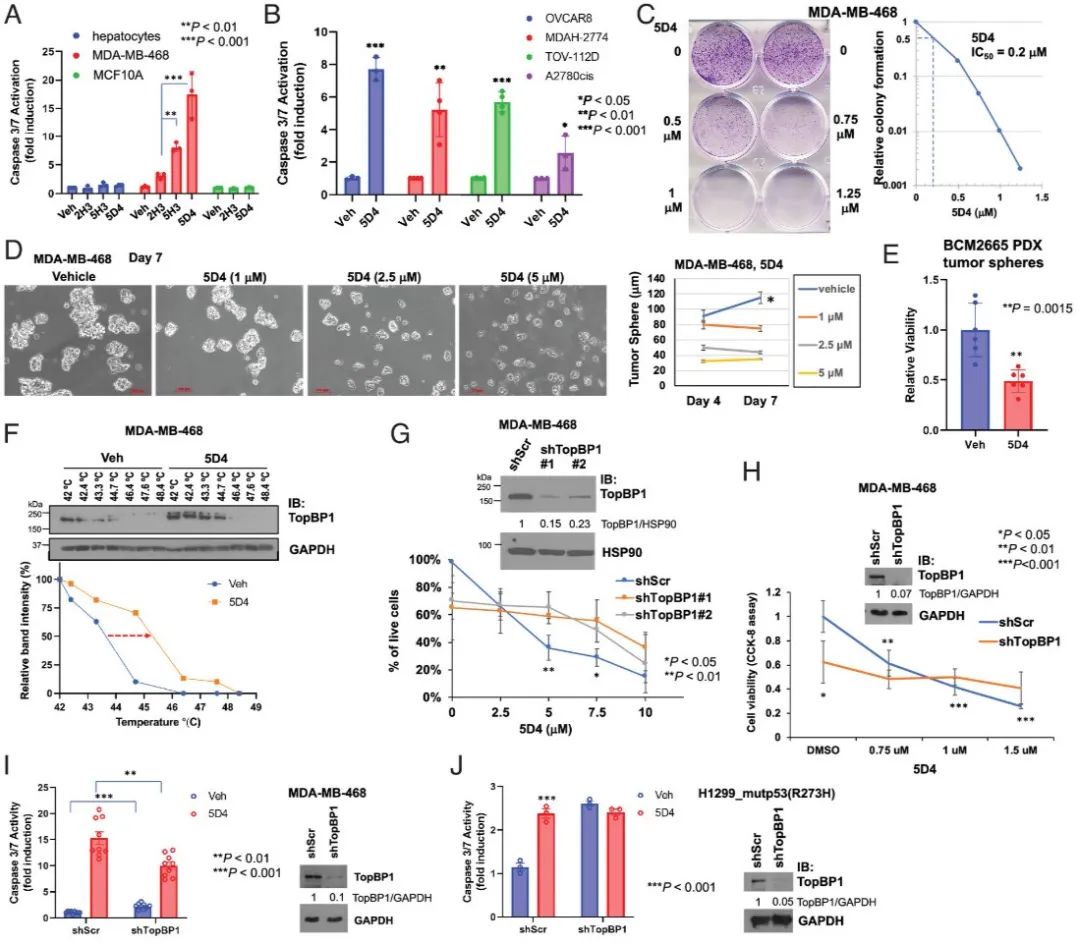 图2 Cpd 5D4 在二维和三维培养的乳腺癌和卵巢癌细胞中诱导细胞凋亡并抑制细胞活力
图2 Cpd 5D4 在二维和三维培养的乳腺癌和卵巢癌细胞中诱导细胞凋亡并抑制细胞活力
[1]
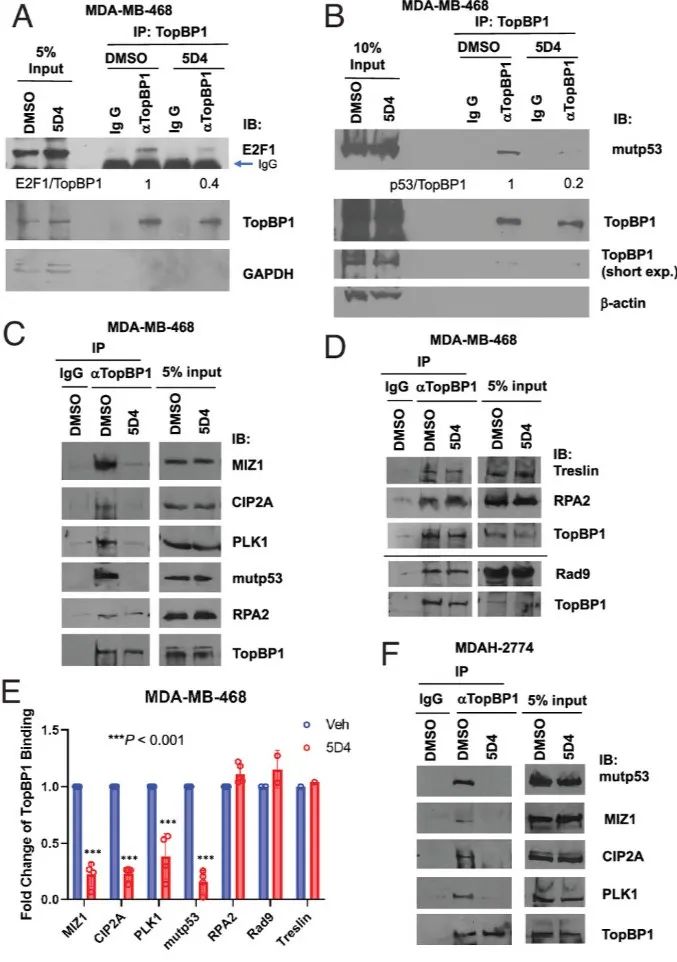 图3 Cpd 5D4 处理阻断了 TopBP1 与 E2F1、mutp53、MIZ1、CIP2A 或 PLK1 的相互作用,但对其与 RPA2、Rad9 或 Treslin 的结合没有影响
图3 Cpd 5D4 处理阻断了 TopBP1 与 E2F1、mutp53、MIZ1、CIP2A 或 PLK1 的相互作用,但对其与 RPA2、Rad9 或 Treslin 的结合没有影响
[1]
2. 序转录组分析揭示TopBp1抑制剂具有MYC活性紧接着通过转录组分析研究,以阐明TopBP1抑制剂(特别是CalAM和5D4)抗癌作用的机制。CalAM和5D4均可激活与凋亡和自噬相关的E2F1靶基因,以及p53/p63/p73靶基因。这支持了抑制剂破坏TopBP1/E2F1和TopBP1/mutp53复合物形成的观点,重新激活E2F1诱导的细胞凋亡和自噬,同时阻断mutp53功能获得(GOF)。5D4对MYC基因特征表现出显著的抑制作用,表明了其抗MYC活性。5D4处理诱导MIZ1染色质结合p21
Cip1
启动子的多种癌细胞系,包括MDA-MB-468、MDAH-2774、HCC95和NCI-H2170。TopBP1通常结合MIZ1,抑制其在p21
Cip1
转激活中的功能,在MDA-MB-468和MDAH-2774细胞中消耗MIZ1会抑制5D4的抗癌作用,这表明MIZ1参与了5D4诱导的细胞活力抑制和p21
Cip1
的诱导。这揭示了5D4抗癌活性的分子机制及其对MYC相关途径的潜在影响。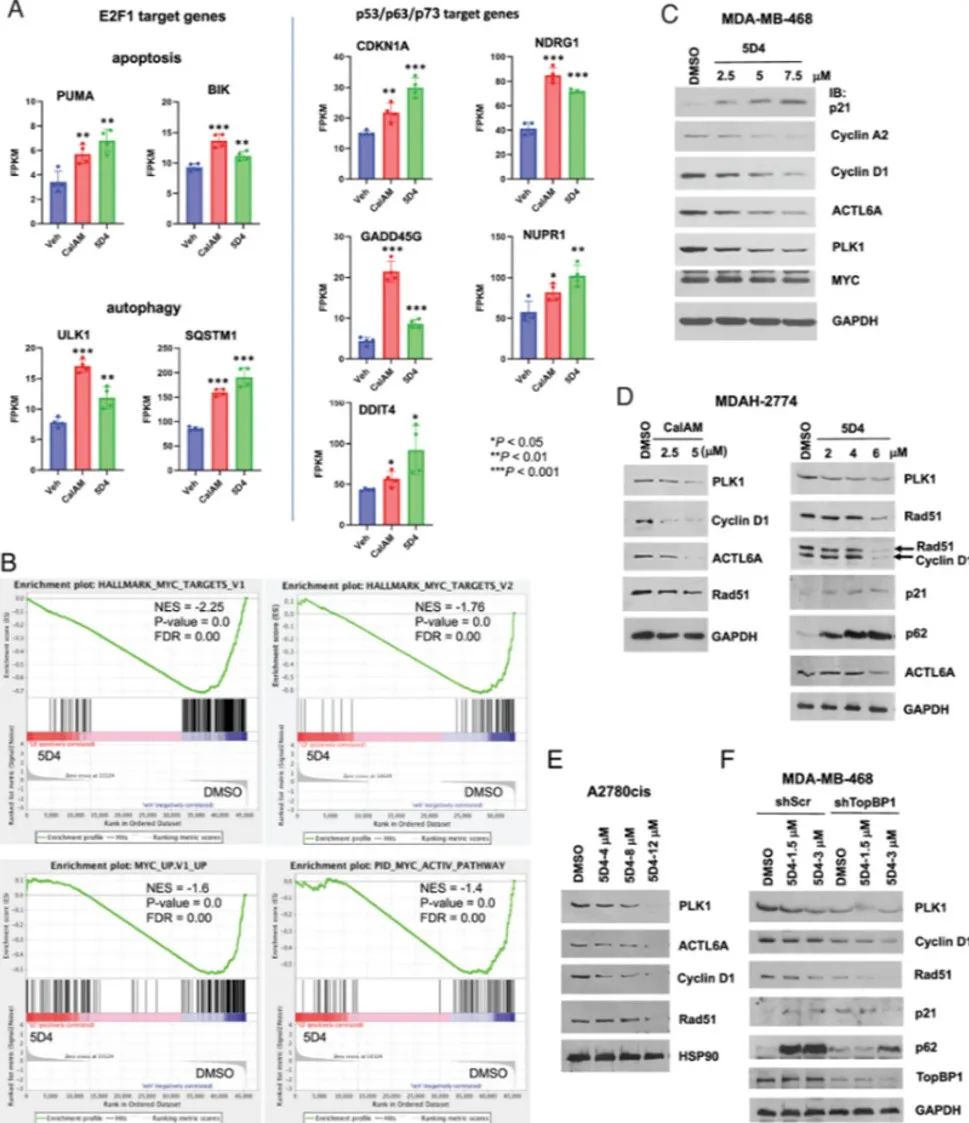 图4 CalAM 和 5D4 可增强凋亡和自噬过程中 E2F1 靶基因以及 p53/p63/p73 靶基因的表达,但会降低 MYC 靶基因的表达
图4 CalAM 和 5D4 可增强凋亡和自噬过程中 E2F1 靶基因以及 p53/p63/p73 靶基因的表达,但会降低 MYC 靶基因的表达
[1]
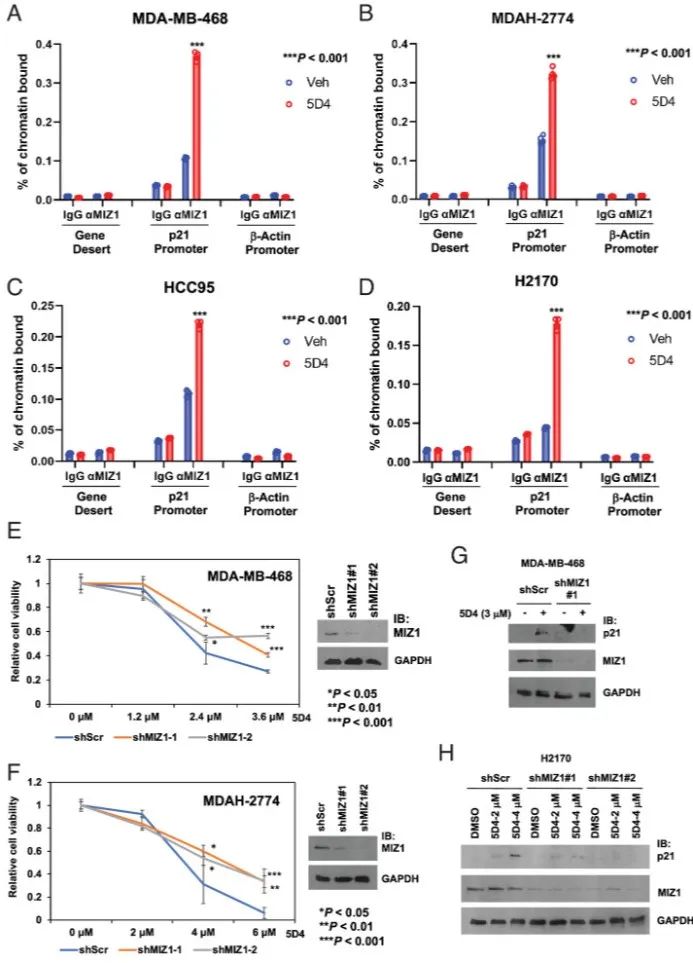 图5 Cpd 5D4 处理可增强 MIZ1 与 p21
图5 Cpd 5D4 处理可增强 MIZ1 与 p21
Cip1
启动子的结合
[1]
3. Cpd 5D4 抑制卵巢癌和乳腺癌异种移植物的生长
5D4在体内抑制卵巢癌和乳腺癌异种移植物生长。建立DAH-2774卵巢癌和MDA-MB-468乳腺癌异种移植物,此外,该研究将其评估扩展到乳腺癌患者来源的异种移植(PDX)模型BCM2665,该模型的特征是三阴性乳腺癌(TNBC)。在这个PDX模型中,5D4也显示出肿瘤生长的显著减少。重要的是,小鼠对5D4耐受良好,没有明显的体重变化或明显的副作用。这些发现强调了5D4作为体内抑制肿瘤生长的有效药物的潜力。
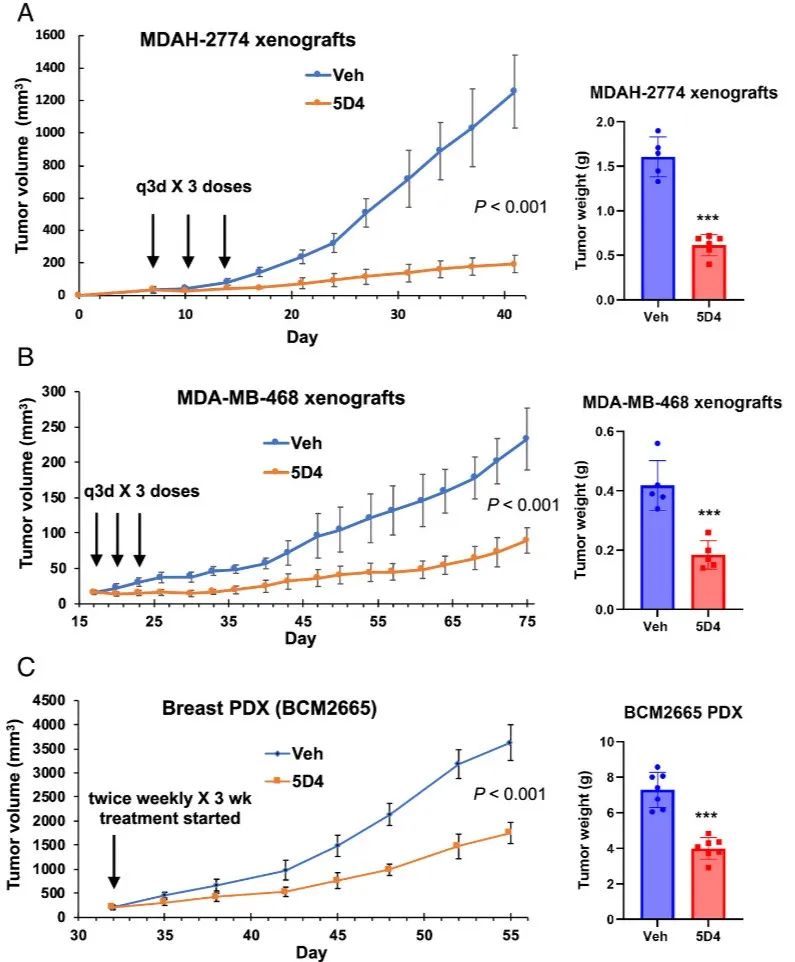
图6 Cpd 5D4 可明显降低卵巢癌和乳腺癌异种移植的肿瘤生长
[1]
4. 5D4 与 PARP抑制剂(PARPi)联合的协同抗癌作用
PARP抑制剂被临床批准用于同源重组(HR)缺乏症患者。TopBP1和PLK1之间的相互作用对于Rad51染色质募集和HR DNA修复至关重要。先前的研究发现CalAM, TopBP1- brct7 /8抑制剂,阻断TopBP1/PLK1相互作用并使细胞对PARPi奥拉帕尼敏感。目前的研究将这项研究扩展到5D4,证明了它类似地阻断TopBP1/PLK1相互作用的能力。本研究评估了5D4和PARPi在hr精通癌细胞中的协同抗癌作用。MDA-MB-468、MDA-2774和A2780cis细胞单独对5D4或CalAM有应答,但与rucaparib联合治疗时表现出更大的应答性。通过组合指数(CI)分析确认协同效应。在肺癌细胞(HCC95和HCC2814)和其他PARPi(如talazoparib和veliparib)中观察到这种作用。重要的是,该组合在未转化的AML12小鼠肝细胞中没有引起影响。此外,TopBP1抑制剂降低了Rad51和PLK1的表达,阻止了rucaparib诱导的Rad51病灶的形成,这表明TopBP1抑制剂,包括5D4,在HR精通的癌细胞中抑制HR并与PARPi协同作用。5D4和GeA-69在抑制细胞活力和促进细胞凋亡方面显示协同效应,当这两种抑制剂联合使用时,细胞活力降低,细胞凋亡增强(如图8)。免疫印迹进一步支持这种协同作用,显示协同抑制MYC及其下游靶标,包括ACTL6A、Cyclin D1和Rad51。这表明针对TopBP1和PARP14的潜在治疗策略可以增强抗癌效果。
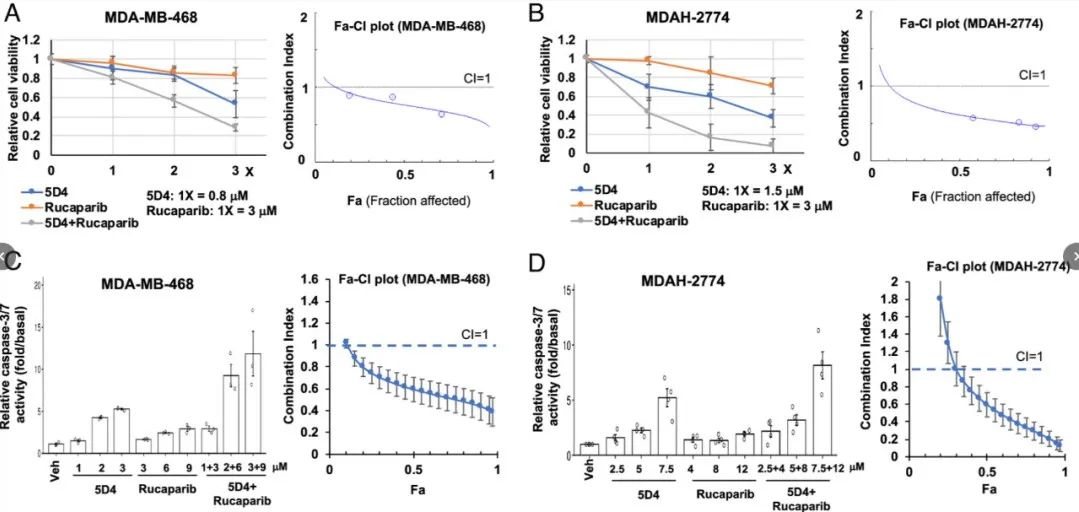
图7 Cpd 5D4 和 PARP1/2 抑制剂能协同抑制乳腺癌和卵巢癌细胞的活力
[1]
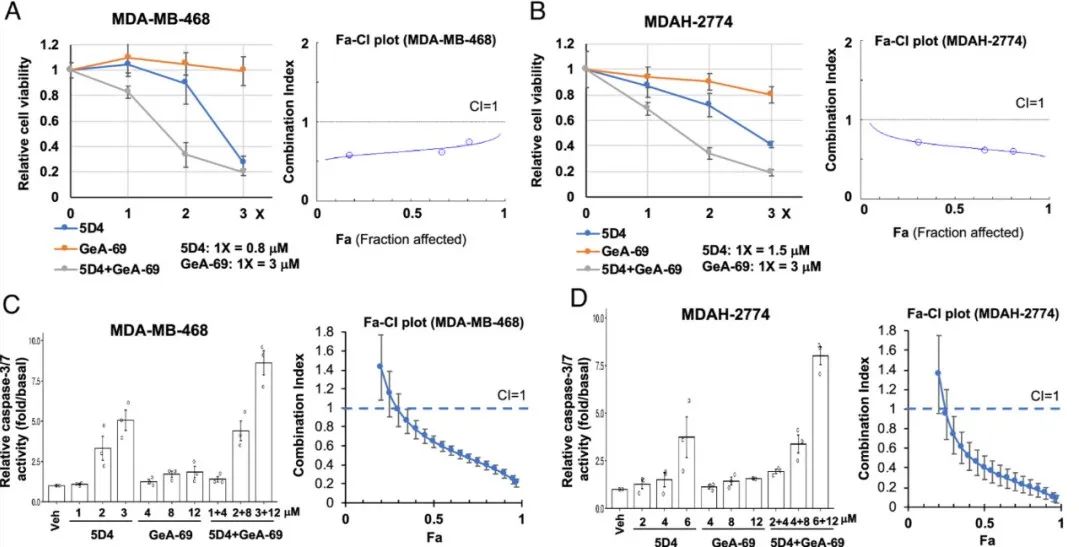 图8 Cpd 5D4 和 PARP-14 抑制剂 GeA-69 能协同抑制乳腺癌和卵巢癌细胞的活力
图8 Cpd 5D4 和 PARP-14 抑制剂 GeA-69 能协同抑制乳腺癌和卵巢癌细胞的活力
[1]
5D4联合PARP抑制剂talazoparib在乳腺癌患者源性异种移植(PDX)模型中的体内疗效,5D4与talazoparib联用可协同抑制肿瘤生长,无明显毒性和小鼠体重变化。线性混合模型分析证实了治疗对肿瘤大小的显著影响,时间与治疗的相互作用进一步支持了协同效应。此外,在另一种对talazoparib耐药的TNBC PDX BCM3107中进行的实验表明,BCM3107对5D4反应良好。5D4联合talazoparib治疗BCM3107有效抑制肿瘤生长,无明显毒性。这些发现强调了TopBP1抑制剂(特别是5D4)与PARP抑制剂(如talazoparib)联合治疗乳腺癌的潜力。
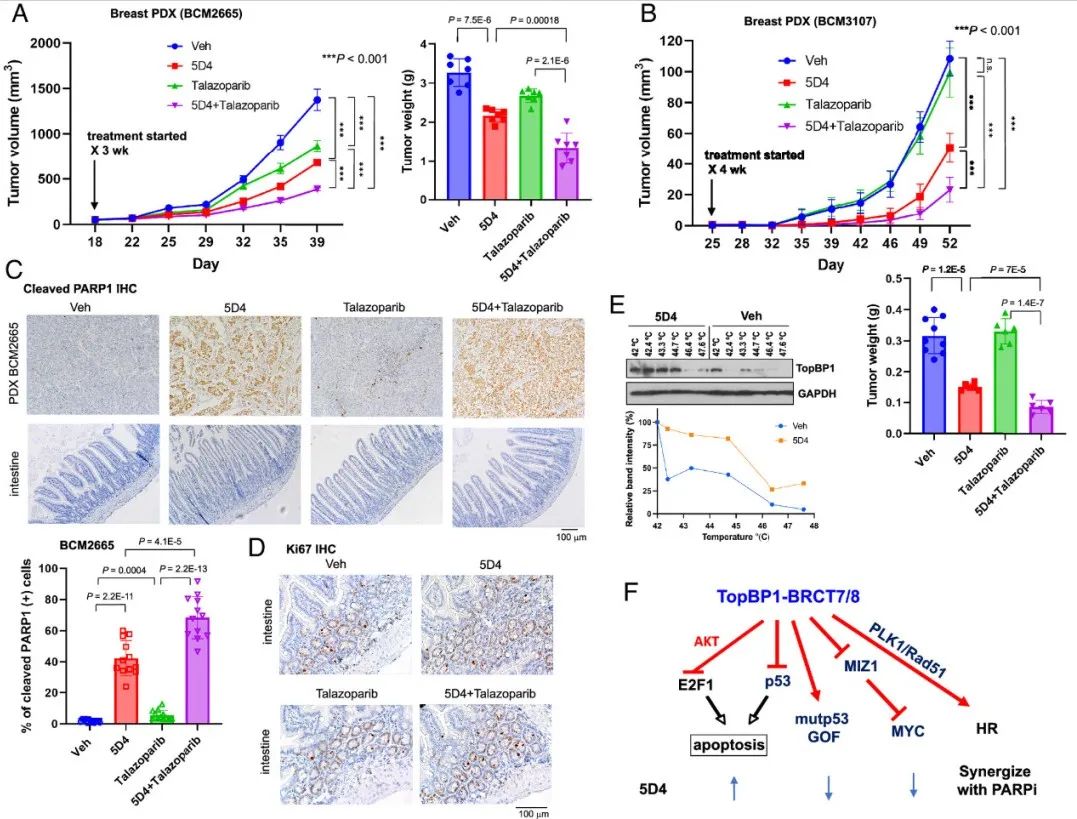 图9 Cpd 5D4 和 talazoparib 能协同抑制两种乳腺癌 PDX 模型中的肿瘤生长
图9 Cpd 5D4 和 talazoparib 能协同抑制两种乳腺癌 PDX 模型中的肿瘤生长
[1]
研究小结
CalAM和新化合物5D4这两种TopBP1-BRCT7/8抑制剂都具有抗MYC活性。在体外,5D4可阻断TopBP1-BRCT7/8与pS1159-TopBP1磷酸肽或mutp53(DBD)的结合。细胞热转移试验(CETSA)证实了 5D4 在乳腺癌细胞和患者异种移植(PDX)肿瘤中与 TopBP1的结合。5D4可抑制 TopBP1 与E2F1、mutp53、PLK1、MIZ1和CIP2A的相互作用,而TopBP1或MIZ1的耗竭会降低5D4的抗癌效果。MYC和TopBP1都会竞争MIZ1的结合。靶向TopBP1-BRCT7/8的小分子抑制剂可能会将 MIZ1从TopBP1复合物中释放出来,使其能够抑制癌症中的 MYC 活性。除了对 MYC 的影响外,TopBP1-BRCT7/8 抑制剂还能通过激活 E2F1 介导的细胞凋亡和抑制 mutp53 功能增益来促进抗癌活动。TopBP1-BRCT7/8 抑制剂与PARP1/2或PARP14抑制剂之间的协同作用可归因于几种机制,包括抑制Rad51招募、下调DNA修复蛋白以及改善PARP 抑制剂耐药性。
参考文献 [1] Lin FT, Liu K, Garan LAW, et al. A small-molecule inhibitor of TopBP1 exerts anti-MYC activity and synergy with PARP inhibitors. Proc Natl Acad Sci U S A. 2023, 120(44): e2307793120.[2] Chowdhury P, Lin GE, Liu K, Song Y, Lin FT, Lin WC. Targeting TopBP1 at a convergent point of multiple oncogenic pathways for cancer therapy. Nat Commun. 2014, 5: 5476.
供稿:余涛
校稿:沙文婕/徐文倩
编辑:邓文帅/毛丽韫
华东理工大学/上海市新药设计重点实验室/李洪林教授课题组
▼招聘博后▼华东理工大学李洪林教授团队诚聘博士后
 Li’s Lab地址:上海市梅陇路130号 电话:021-64250213课题组网站:http://www.lilab-ecust.cn
Li’s Lab地址:上海市梅陇路130号 电话:021-64250213课题组网站:http://www.lilab-ecust.cn
长按扫码可关注




 ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง
ufabet
มีเกมให้เลือกเล่นมากมาย: เกมเดิมพันหลากหลาย ครบทุกค่ายดัง


